فهرست مطالب
متداولترین تکنیکهای مهندسی ژنتیک در کارهای تحقیقاتی
مهندسی ژنتیک (اصلاح ژنتیکی) فرآیندی است که از فناوری های مبتنی بر آزمایشگاه برای تغییر ساختار DNA یک موجود زنده استفاده می کند. این ممکن است شامل تغییر یک جفت باز منفرد (A-T یا C-G)، حذف یک ناحیه از DNA یا افزودن بخش جدیدی از DNA باشد.
اصطلاح مهندسی ژنتیک به طور کلی برای اشاره به روش های فناوری DNA نوترکیب، که از تحقیقات پایه در ژنتیک میکروبی پدید آمدهاست، استفاده میشود. تکنیکهای بهکاررفته در مهندسی ژنتیک منجر به تولید محصولات مهم پزشکی از جمله انسولین انسانی، هورمون رشد انسانی و واکسن هپاتیت B و همچنین به توسعه موجودات اصلاح شده ژنتیکی مانند گیاهان مقاوم به بیماری شدهاست.
تاریخچه تکنیکهای مهندسی ژنتیک
اصطلاح مهندسی ژنتیک در ابتدا به تکنیکهای مختلفی اطلاق میشود که برای تغییر یا دستکاری موجودات از طریق فرآیندهای وراثت و تولید مثل استفاده میشود. به این ترتیب، این اصطلاح هم انتخاب مصنوعی و هم تمام مداخلات تکنیک های زیست پزشکی، از جمله لقاح مصنوعی، لقاح آزمایشگاهی ، شبیه سازی و دستکاری ژن را دربرمیگیرد.
با این حال، در اواخر قرن بیستم، این اصطلاح به طور خاص به روشهای فناوری DNA نوترکیب (یا شبیهسازی ژن) اشاره داشت، که در آن مولکولهای DNA از دو یا چند منبع یا در سلولها یا در شرایط آزمایشگاهی ترکیب میشوند و سپس وارد ارگانیسم های میزبان می شود که در آن قادر به تکثیر هستند.
امکان فناوری DNA نوترکیب با کشف آنزیمهای محدودکننده در سال 1968 توسط میکروبیولوژیست سوئیسی Werner Arber پدیدار شد. سال بعد، میکروبیولوژیست آمریکایی، Hamilton O. Smith، آنزیمهای محدودکننده نوع II را خالصسازی کرد، که مشخص شد برای مهندسی ژنتیک به دلیل توانایی آنها در شکافتن یک مکان خاص در DNA ضروری هستند، خالصسازی کرد.
با تکیه بر کار اسمیت، زیست شناس مولکولی آمریکایی Daniel Nathans در سال های 1970-1971 به پیشرفت تکنیک نوترکیب DNA کمک کرد و نشان داد که آنزیمهای نوع II میتوانند در مطالعات ژنتیکی مفید باشند. مهندسی ژنتیک مبتنی بر نوترکیب در سال 1973 توسط بیوشیمیدانان آمریکایی، Stanley N. Cohen و Herbert W. Boyer، که از اولین کسانی بودند که DNA را به قطعات تقسیم کردند، قطعات مختلف را دوباره به هم پیوند دادند و ژنهای جدید را در باکتری E. coli وارد و تکثیر کردند.
فرآیند مهندسی ژنتیک

بیشتر فناوری DNA نوترکیب شامل قراردادن ژنهای خارجی در پلاسمیدهای آزمایشگاهی باکتریها است. پلاسمیدها حلقه های کوچکی از DNA (بخشی از کروموزوم باکتری نیستند) هستند. با این وجود، آنها توانایی هدایت سنتز پروتئین را دارند و مانند DNA کروموزومی، تکثیر میشوند و به نسل بعدی باکتری منتقل میشوند.
بنابراین، با ترکیب DNA خارجی در یک باکتری، محققان میتوانند تعداد تقریبا نامحدودی از نسخههای ژن وارد شده را به دست آورند. علاوه بر این، اگر ژن درج شده عمل کند، باکتری اصلاح شده پروتئین مشخصشده توسط DNA خارجی را تولید میکند.
نسل بعدی تکنیکهای مهندسی ژنتیک که در اوایل قرن بیست و یکم پدیدار شد، بر روی ویرایش ژن متمرکز شد. ویرایش ژن، براساس فناوری موسوم به CRISPR-Cas9، به محققان اجازه میدهد تا با ایجاد تغییرات بسیار خاص در DNA موجودات زنده، توالی ژنتیکی موجود زنده را با توجه به هدف مورد نیاز، دستکاری کنند. ویرایش ژن طیف گستردهای از کاربردها را دارد که برای اصلاح ژنتیکی گیاهان زراعی و دام و موجودات مدل آزمایشگاهی (مانند موش) استفاده میشود.
ژن درمانی وارد کردن یک ژن طبیعی به ژنوم یک فرد به منظور ترمیم جهشی است که باعث یک بیماری ژنتیکی می شود. هنگامی که یک ژن طبیعی در یک هسته جهش یافته قرار میگیرد، به احتمال زیاد در یک مکان کروموزومی متفاوت از آلل معیوب ادغام میشود.
اگرچه این ممکن است جهش را ترمیم کند، اما اگر ژن طبیعی در یک ژن عملکردی دیگر ادغام شود، ممکن است جهش جدیدی ایجاد شود. اگر ژن طبیعی جایگزین آلل جهش یافته شود، این احتمال وجود دارد که سلولهای تبدیل شده تکثیر شوند و به اندازه کافی محصول ژنی طبیعی تولید کنند تا کل بدن به فنوتیپ بیمار بازگردد.
تکنیکهای رایج در مهندسی ژنتیک
در ادامه اصول مهندسی ژنتیک و تکنیکهای آن شرح دادهشدهاست؛
(1) چگونه عناصر رایج فنآوریهای کنونی شامل: نیاز به رخدادن شکست کروموزوم هستند،
(2) استفاده از سنجشهای ژنوتیپ خاص و حساس برای تشخیص ژنومهای تغییر یافته و
(3) روشهای ارسال که برروی خصوصیات تغییرات ژنی تأثیر میگذارد.
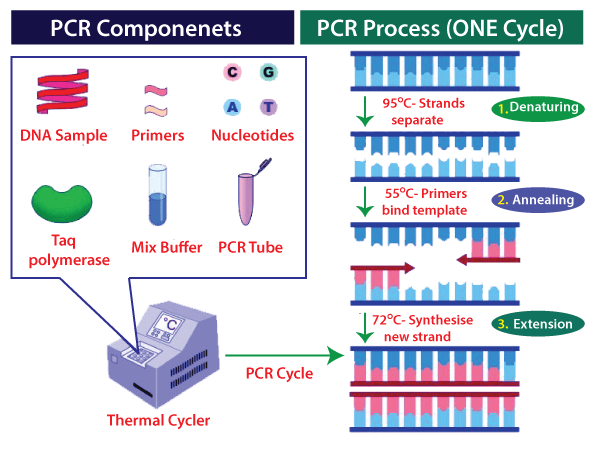
PCR – polymerase chain reaction
PCR تکنیکی که برای ساختن کپی های متعدد از یک بخش خاص از DNA به سرعت و با دقت استفاده میشود. این تکنیک در سال 1983 توسط Kary B. Mullis، بیوشیمیدان آمریکایی که در سال 1993 جایزه نوبل شیمی را برای اختراع خود دریافت کرد، توسعه یافت. قبل از توسعه PCR، روشهایی که برای تکثیر یا تولید کپی از قطعات DNA نوترکیب استفاده میشد زمانبر و کار فشرده بود.
تکنیک PCR مبتنی بر فرآیندهای طبیعی است که سلول برای تکثیر یک رشته DNA جدید استفاده میکند. فقط چند ماده بیولوژیکی برای PCR مورد نیاز است:
جزء جدایی ناپذیر DNA الگو (DNA حاوی ناحیه ای که قرار است کپی شود) است. تنها اطلاعات مورد نیاز برای تکثیر این قطعه، توالی دو ناحیه کوتاه نوکلئوتید (زیر واحدهای DNA) در دو انتهای ناحیه مورد نظر است. پرایمرها در مکانهای مکمل خود به الگو متصل میشوند و به عنوان نقطه شروع برای کپی عمل میکنند. انواع مختلف PCR را در شکل زیر نشاندادهشدهاست.

تکنیک ژل الکتروفورز
ژل الکتروفورز یک تکنیک آزمایشگاهی است که برای جداسازی مولکولهای DNA ،RNA و پروتئین بر اساس اندازه و بار الکتریکی آنها استفاده میشود. اساس ژل الکتروفورز این است که از جریان الکتریکی برای حرکت مولکولها برای جدا شدن از طریق ژل استفاده میشود. منافذ ژل، مانند الک عمل کرده و مولکولهای کوچکتر سریعتر از مولکولهای بزرگ حرکت میکنند. آزمایش الکتروفورز معمولاً درون جعبهای انجام میشود که یک انتهای آن بار مثبت و انتهای دیگر بار منفی دارد.
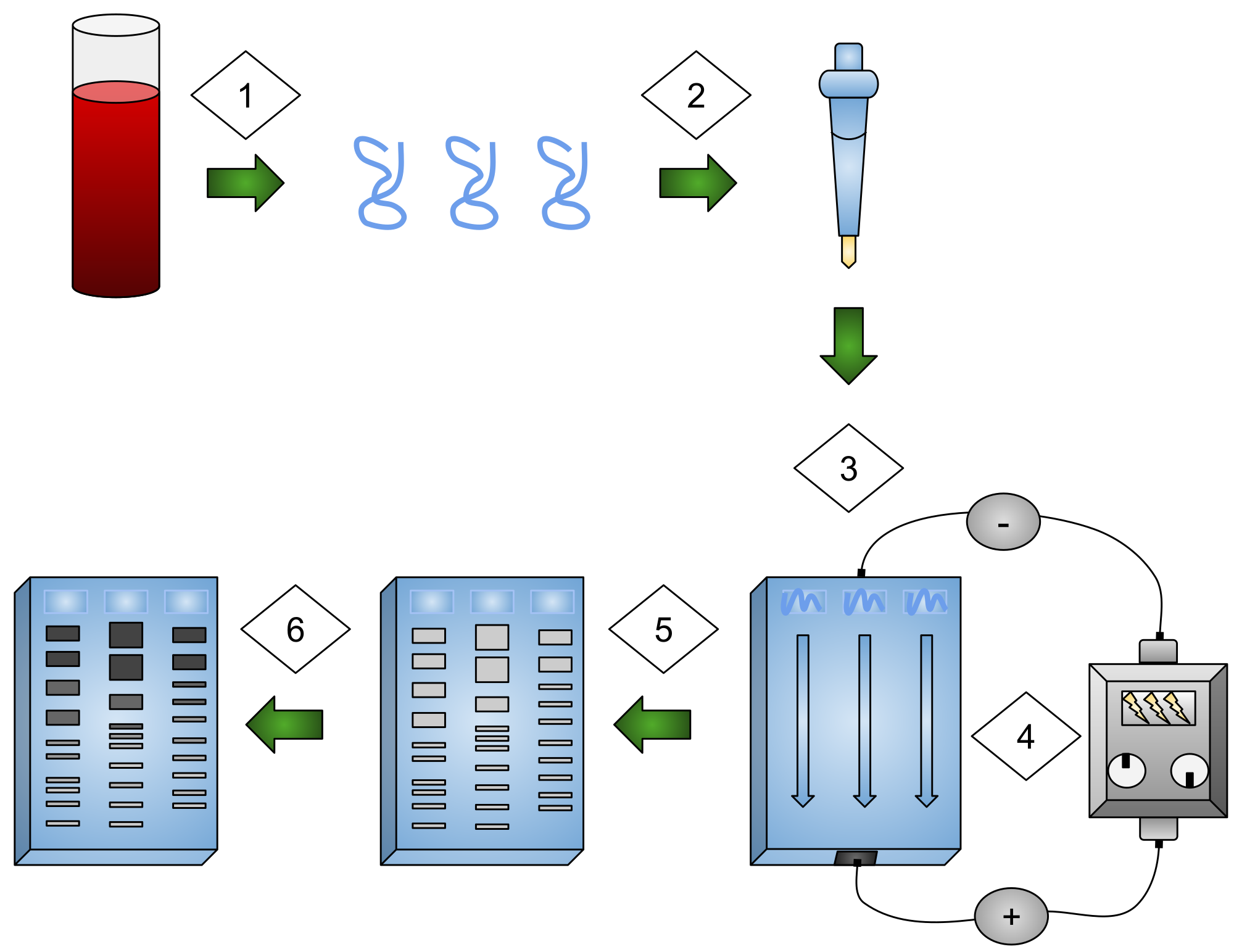
SDS – page
به جداسازی ماکرومولکولها در یک میدان الکتریکی الکتروفورز گفته میشود. یکی از تکنیک های مهندسی ژنتیک برای جداسازی پروتئینها با الکتروفورز ژل پلی اکریل آمید سدیم دودسیل سولفات (SDS – PAGE) است که در آن، از ژل پلی اکریل آمید ناپیوسته به عنوان یک محیط پشتیبانی و دودسیل سولفات سدیم (SDS) برای تغییر رنگ پروتئینها استفاده میشود.
طراحی پرایمر
طراحی پرایمر، فرآیند ایجاد توالی های DNA کوتاه است که می تواند به مناطق خاصی از DNA هدف متصل شود و تقویت PCR را آغاز کند. پرایمرها باید طول، محتوای G/C، دمای ذوب و ویژگی بهینه داشته باشند تا از اتصال غیر اختصاصی، تشکیل پرایمر-دایمر و راندمان تقویت پایین جلوگیری شود.
ابزارهای طراحی پرایمر مانند Primer-Blast، Oligo یا Primer3 میتوانند به محققان کمک کنند تا پرایمرها را بر اساس توالی هدف، اندازه محصول مورد نظر و سایر پارامترها طراحی کنند. همچنین میتوان از کاربردهای مختلفی آن به شبیه سازی ژن، تشخیص جهش، تجزیه و تحلیل بیان ژن، شناسایی پاتوژن و ژنوتیپ SNP اشاره کرد.
کلونینگ
کلونینگ یا شبیهسازی مولکولی، ایجاد یک کپی از یک سلول یا کل یک موجود زنده است. یک کلون دقیقاً همان DNA سلول یا موجود زنده اصلی را دارد. موجودات زنده کوچک، مانند باکتریها و مخمرها، با ایجاد کپیهای دقیقی از خود تولید مثل میکنند. بسیاری از سلولهای موجود در گیاهان و جانوران – به جز سلولهای تولید مثل (تخمک و اسپرم) – کلون سلولهای قدیمیتر هستند.
شبیهسازی که توسط انسان انجام میشود، شبیه سازی مصنوعی نامیده میشود. از زمان های قدیم، مردم گیاهان را با کاشت ساقه یا برگ های بریده شده از گیاهان دیگر شبیه سازی می کردند. با این حال، شبیه سازی حیوانات تا سال 1900 توسعه نیافته بود. دو نوع اصلی شبیه سازی حیوانات وجود دارد: تولید مثلی و درمانی.
- شبیه سازی تولید مثل
شبیه سازی تولیدمثلی ایجاد فرزندانی است که مشابه حیوانات اصلی هستند. برای انجام این کار، دانشمندان DNA را از یک سلول از حیوان اصلی خارج میکنند. سپس تخمی را از حیوان دیگری میگیرند و DNA آن تخم را جدا میکنند. سپس، DNA حیوان اصلی را در تخم خالی قرار دادند. پس از آن، تخمک به جنین یا شکل اولیه حیوان شبیه سازی شده تبدیل میشود. در نهایت، جنین در داخل یک حیوان ماده قرار میگیرد که کلون را تا زمانی که آماده تولد شود حمل میکند.
شبیه سازی تولید مثل آسان نیست. جنینهای شبیه سازی شده اغلب رشد نمیکنند. اولین پستاندار بالغ که با موفقیت شبیه سازی شد یک گوسفند بود. این کلون که دالی نام داشت در سال 1996 در اسکاتلند متولد شد. دانشمندان بعداً خوکها، موشها، سگها، اسبها و حیوانات دیگر را شبیه سازی کردند.

در سال 2005 سازمان ملل متحد اعلامیه ای را علیه شبیه سازی انسان تصویب کرد.
- شبیه سازی درمانی
شبیه سازی درمانی استفاده از شبیه سازی برای درمان بیماریها و اختلالات انسانی است. هنوز در حال تحقیق و توسعه است. هدف آن، تولید سلولهای جدید سالم با شبیه سازی سلولهای خود بیمار است. سلولهای جدید به بدن بیمار پیوندزده میشوند، جایی که میتوانند جایگزین سلولهای آسیب دیدهشوند. از آنجایی که سلولهای جدید حاوی DNA خود بیمار هستند، توسط سیستم ایمنی رد نمیشوند.
همچنین بخوانید: وکتور کلونینگ؛ دستاورد جنجال آفرین در جهان علم!
دانشمندان فکر میکنند که سلولهای شبیه سازی شده ممکن است برای درمان بیماری آلزایمر، آسیبهای نخاعی و سایر شرایط جدی مورد استفاده قرارگیرند. با این حال، بسیاری از مردم به روش تولید سلولهای شبیه سازی شده اعتراض دارند. یک سلول تخمک انسانی (از یک اهدا کننده) با DNA بیمار کاشته میشود و در نتیجه جنین ایجاد میشود. این جنین تا زمانی رشد میکند که سلولهای خاصی به نام سلولهای بنیادی از آن گرفته شود. سپس جنین از بین میرود.
استخراج DNA و RNA
استخراج DNA و RNA هر دو روشی هستند که شامل جداسازی و خالص سازی اسیدهای نوکلئیک از سلول ها می شود. تفاوت اصلی بین استخراج DNA و RNA در سطوح pH نهفته است. برای استخراجDNA، pH مورد نیاز 8 است، در حالی که برای استخراجRNA، 4.7 است. DNA تمایل به دناتوره شدن و عبور از مرحله آلی در pH اسیدی 2 دارد.
سلولها با استفاده از بافر لیزکننده شکسته میشوند. لیز شدن به معنای شکسته شدن است. ماکرومولکولها با استفاده از آنزیمهایی مانند پروتئازهایی که پروتئینها را تجزیه میکنند و ریبونوکلئازها (RNase) که RNA را تجزیه میکنند، غیرفعال میشوند.
سپس DNA با استفاده از الکل رسوب میکند. تجزیه و تحلیل RNA برای مطالعه الگوهای بیان ژن در سلولها انجام میشود. RNA به طور طبیعی بسیار ناپایدار است زیرا RNA ها معمولاً در طبیعت وجود دارند و غیرفعال کردن آنها بسیار مشکل است. شبیه به DNA، استخراج RNA شامل استفاده از بافرها و آنزیمهای مختلف برای غیرفعال سازی ماکرومولکولها و حفظ RNA است.
Western – blotting
وسترن بلات یک روش آزمایشگاهی مهندسی ژنتیک است که برای تشخیص مولکولهای پروتئینی خاص از بین مخلوط پروتئینها استفاده میشود. این مخلوط میتواند شامل تمام پروتئینهای مرتبط با بافت یا نوع سلولی خاص باشد. وسترن بلات همچنین میتواند برای ارزیابی اندازه پروتئین مورد علاقه و اندازه گیری میزان بیان پروتئین مورد استفاده قرار گیرد.
Microarrays
یکی از تکنیکهای مهندسی ژنتیک ریزآرایهها (Microarrays) بوده که مجموعهای از پروبهای DNA هستند که معمولا در موقعیتهای مشخص به یک سطح جامد مانند یک سطح لغزنده شیشهای متصل میشوند که قطعات DNA نمونه را میتوان هیبرید کرد. DNA تک رشتهای یا قطعات RNA مقابل از نمونه مورد علاقه در شرایط سختی بالا به ریزآرایه DNA هیبرید میشوند. میزان هیبریداسیون تشخیص داده شده برای یک پروب خاص متناسب با تعداد قطعات اسید نوکلئیک در نمونه است.
سایر تکنیکهای مهندسی ژنتیک
- NGSیا Next Generation Sequencing
- توالی یابی RNA
- الایزا
- فلوسایتومتری
- کروماتوگرافی
- ساخت DNA نوترکیب
- Real-time PCR
نتیجه گیری
تکنیکهای مهندسی ژنتیک برای بسیاری از زمینه ها ضروری است مانند:
- علوم پایه: از تکنیکهای مهندسی ژنتیک برای مطالعه عملکرد ژن ها و برهمکنش آنها با سایر ژنها و محیط استفاده میشود.
- توسعه دارو: تکنیکهای مهندسی ژنتیک برای تولید پروتئین های درمانی و آنتی بادیها برای درمان بیماری ها استفاده میشود.
- علوم دامی: از تکنیکهای مهندسی ژنتیک برای تولید حیوانات تراریخته استفاده میشود که میتوانند به عنوان مدلی برای بیماری های انسانی مورد استفاده قرار گیرند.
- تولید صنعتی: تکنیکهای مهندسی ژنتیک برای تولید آنزیمها و سایر پروتئینهایی که میتوانند در فرآیندهای صنعتی استفاده شوند، استفاده میشود.
- کشاورزی: از تکنیکهای مهندسی ژنتیک برای تولید محصولاتی استفاده میشود که در برابر آفات و بیماریها مقاوم هستند، محتوای تغذیهای بهتری دارند و میتوانند در شرایط نامطلوب رشد کنند.
- پزشکی: تکنیکهای مهندسی ژنتیک برای توسعه ژن درمانی برای درمان بیماری های ژنتیکی استفاده میشود.
دانستن تکنیکهای مهندسی ژنتیک مهم است زیرا ما را قادر میسازد تا بفهمیم ژنها چگونه کار میکنند و چگونه میتوان آنها را برای تولید صفات یا محصولات مورد نظر دستکاری کرد. این دانش کاربردهای عملی زیادی در زمینههای مختلف دارد و می تواند به ما در ایجاد درمان های جدید برای بیماریها، بهبود عملکرد محصول و ایجاد محصولات صنعتی جدید کمک کند.
مترجم و نویسنده: مهرشید موسویون
منابع:
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7140808/
- https://bio.libretexts.org/Bookshelves/Biochemistry/Supplemental_Modules_(Biochemistry)/3._Biotechnology_1/3.1%3A_Gel_Electrophoresis
- https://www.britannica.com/science/genetic-engineering/Process-and-techniques
- https://www.genome.gov/genetics-glossary/Genetic-Engineering
- https://www.yourgenome.org/facts/what-is-genetic-engineering/
- https://www.genome.gov/genetics-glossary/Cloning#:~:text=Cloning%2C%20as%20it%20relates%20to%20genetics%20and%20genomics%2C,particular%20DNA%20segment%20of%20interest%20for%20further%20study.
- https://microbenotes.com/types-of-pcr/
- https://microbeonline.com/polymerase-chain-reaction-pcr-steps-types-applications/
- https://sharebiology.com/primer-designing-demonstration-step-by-step/