فهرست مطالب
پیشرفتهای اخیر در زیستشناسی سلولی، ایمونولوژی، ژنتیک مولکولی و مهندسی ژنتیک منجر به توسعهی محصولات واکسن پیچیدهتر میشود که پاسخهای ایمنی محافظتی را ایجاد میکند. با پیشرفتهای اخیر در تکنیکهای مولکولی کاربردی و بیوتکنولوژی، امکان مهندسی ژنهایی که آنتیبادیها را کد میکنند، فراهم شدهاست. در ادامه میخواهیم به این موضوعات بپردازیم که بیوتکنولوژی آنتیبادیها به چه صورت است؟ و چگونه واکسنهای نوین ساخته میشوند؟

مهندسی ژنتیک
مهندسی ژنتیک بهمعنی دستکاری مصنوعی و نوترکیب “DNA” یا دیگر مولکولهای اسیدنوکلئیک بهمنظور اصلاح یک ارگانیسم یا جمعیت موجودات است. اصطلاح مهندسی ژنتیک بهطور کلی به استفاده از فناوریهای DNA نوترکیب اشاره میکند. تکنیکهای بهکار رفته در مهندسی ژنتیک منجر به تولید محصولات مهم پزشکی مانند انسولین انسانی، هورمون رشد انسانی و واکسن هپاتیت “B” شدهاست.
بیوتکنولوژی
بیوتکنولوژی بهمعنای استفاده از دانش زیستشناسی و تولید محصولات مفید است. برجستهترین حوزهی بیوتکنولوژی تولید پروتئینهای درمانی، آنتیبادیهای منوکلونال (Monoclonal antibodies)، واکسنها و سایر داروها از طریق مهندسی ژنتیک است.
صنعت بیوتکنولوژی تحت سلطهی فناوری DNA نوترکیب یا مهندسی ژنتیک است. این تکنیک شامل پیونددادن یک ژن پروتئین مفید (اغلب یک پروتئین انسانی) به سلولهای تولیدی (سلولهای مخمر، باکتری یا پستانداران در محیط کشت) است که سپس شروع به تولید پروتئین در حجم میکنند. یکی از کاربردهای بیوتکنولوژی و مهندسی ژنتیک، تولید آنتیبادیهای منوکلونال و توسعهی واکسنهای نوین است که در ادامه میخواهیم بیشتر به این موارد بپردازیم.
توسعهی آنتیبادیهای درمانی برای درمان بیماریها
بیش از سه دهه از تایید اولین آنتیبادی منوکلونال توسط سازمان غذا و دارو (FDA) ایالات متحده در سال 1986 میگذرد. در این مدت مهندسی آنتیبادی بهطور چشمگیری تکامل یافتهاست. داروهای آنتیبادی کنونی بهدلیل اختصاصیت بالای خود، اثرات جانبی کمتری دارند. در نتیجه، آنتیبادیهای درمانی به کلاس غالب داروهای جدید توسعهیافته در سالهای اخیر تبدیل شدهاند.
طی پنج سال گذشته، آنتیبادیها به پرفروشترین داروها در بازار دارویی تبدیل شدهاند و در سال 2018، جزو هشت دارو از ده داروی پرفروش در سراسر جهان بودند. ارزش بازار جهانی آنتیبادی منوکلونال درمانی تقریبا 115.2 میلیارد دلار در سال 2018 بود و انتظار میرود تا پایان سال 2019، 150 میلیارد دلار و تا سال 2025، 300 میلیارد دلار درآمد ایجاد کند.
بازار داروهای آنتیبادی درمانی رشد انفجاری را تجربه کردهاست. آنتیبادیهای منوکلونال برای درمان بیماریهای مختلف انسانی مانند بسیاری از سرطانها، بیماریهای خودایمنی، متابولیک و عفونی تایید شدهاند.
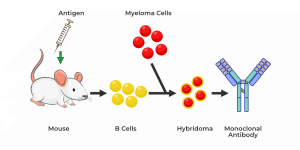
از دسامبر 2019، 79 آنتیبادی منوکلونال درمانی توسط “FDA” ایالات متحده تایید شدهاست، اما هنوز پتانسیل رشد قابلتوجهی دارد. فناوریهای مهندسی آنتیبادی که در توسعهی داروهای آنتیبادی درمانی استفاده میشوند، مانند انسانیسازی آنتیبادیهای منوکلونال، نمایش فاژی (phage display)، تکنولوژی آنتیبادی سلول “B” منفرد و بلوغ میل پیوندی هستند.
آنتیبادیهای منوکلونال
آنتیبادیهای منوکلونال توسط سلولهای B تولید میشوند و بهطور اختصاصی آنتیژنها را هدف قرار میدهند. تکنیک هیبریدوما (hybridoma) توسط کوهلر (Köhler) و میلشتاین (Milstein) در سال 1975 معرفی شد. تکنیک هیبریدوما بهدستآوردن آنتیبادی منوکلونال اختصاصی را در مقادیر زیاد ممکن کردهاست و تحقیقات بنیادی و پتانسیل استفادهی بالینی آنها را بسیار افزایش میدهد.
استفاده از آنتیبادی منوکلونال در یک محیط بالینی باید چندین ویژگی بیوفیزیکی ضروری مانند اتصال آنتیژنی بالا، پایداری بالا و ایمنیزایی کمی داشته باشند. ایمنیزایی آنتیبادی بهمعنای درجهای است که سیستم ایمنی میتواند این عوامل درمانی را تشخیص دهد و به آنها واکنش دهد.
کاربردهای آنتیبادیهای منوکلونال
در حالیکه آنتیبادیهای منوکلونال بهطور معمول در بیوشیمی، زیستشناسی سلولی و ملکولی و تحقیقات پزشکی استفاده میشوند، شاید مهمترین کاربرد آنها بهعنوان داروهای درمانی برای درمان بیماریهای انسانی مانند سرطان، آسم، آرتریت، پسوریازیس (psoriasis)، بیماری کرون (Crohn’s disease)، رد پیوند (rejection)، سردردهای میگرنی و بیماریهای عفونی باشد.
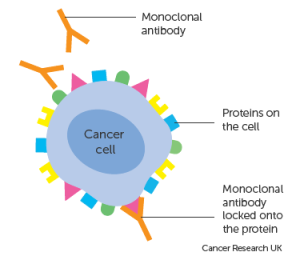
انواع آنتیبادیهای منوکلونال
اولین آنتیبادی منوکلونال درمانی “muromonab-CD3” (OKT3) توسط FDA ایالات متحده تایید شد و شامل یک آنتیبادی موشی ضد “CD3” بیانشده توسط سلول “T” است که بهعنوان یک سرکوبکنندهی سیستم ایمنی برای درمان رد حاد پیوند عمل میکند.
برای غلبهبر مشکلات کاهش پتانسیل ایمنیزایی و اثربخشی، در حالیکه استفاده درمانی از آنتیبادیها را برای مدت طولانی ممکن سازند، محققان تکنیکهایی را برای تبدیل آنتیبادیهای جوندگان به ساختارهایی شبیهتر به آنتیبادیهای انسانی، بدون ازدستدادن ویژگیهای اتصال، ایجاد کردند.
اولین آنتیبادی کایمریک، قطعهی متصلشوندهی آنتیژن (Fab) ضد “GPΙΙb/ΙΙΙa” بود که تجمع پلاکتها را در بیماریهای قلبی-عروقی مهار میکند. این دارو با ترکیب توالیهای دومین (domain) متغیر موش با دومین ثابت انسانی ساخته شد.
سپس آنتیبادی منوکلونال بهنام ریتوکسیمب (rituximab) ساخته شد که یک آنتیبادی کایمریک ضد “CD20” برای لنفوم غیرهوچکین (Non-Hodgkin lymphoma)است.
یکی از پیشرفتهای استثنائی که تائید آنتیبادی منوکلونال درمانی را تسریع کرد، تولید آنتیبادیهای انسانی با تکنیک پیوند مناطق تعیینکنندهی مکمل (complementary-determining region) یا (CDR) بود. در پیوند CDR، توالیهای CDR آنتیبادی غیرانسانی بهمنظور حفظ اختصاصیت به یک توالی چهارچوب انسانی پیوند زده میشوند. آنتیبادیهای منوکلونال انسانی، تنها دارای CDR های زنجیرهی سبک و سنگین موش هستند.
اولین آنتیبادی منوکلونال انسانی تاییدشده توسط FDA ایالات متحده در سال 1997، آنتیبادی ضدگیرندهی “IL-2” بهنام داکلیزومب (daclizumab) بود که برای جلوگیری از رد پیوند استفاده میشود. انسانیسازی آنتیبادیها، امکان استفادهی بالینی کلاس جدیدی از مواد بیولوژیکی برای مقابله با بیماریهایی که نیاز به درمان طولانیمدت (سرطانها و خودایمنیها) دارند، فراهم کرد.
براساس موفقیت آنتیبادیهای منوکلونال انسانی، یک فناوری کلیدی برای بهدستآوردن آنتیبادیهای منوکلونال بهطور کامل انسانی در سال 1990 توسط (Sir Gregory P. Winter) کشف شد. این تکنیک مبتنیبر نمایش فاژی بود، که در آن ژنهای اگزوژن (exogenous) متنوعی در باکتریوفاژهای رشتهای گنجانده میشوند تا یک کتابخانه تشکیل دهند. سپس پروتئینهای کتابخانه برروی سطح فاژ بهصورت ادغام با پروتئین پوششی فاژ ارائه میشوند که امکان انتخاب اتصالدهندههای اختصاصی و ویژگیهای میل ترکیبی را فراهم میکند.
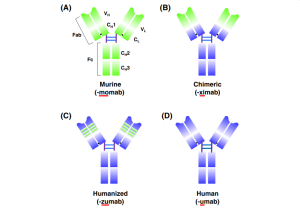
تکنیک هیبریدوما
روش سنتی هیبریدوما موش با ایمنسازی موشها از طریق آنتیژنهای مورد نظر برای تحریک پاسخ ایمنی شروع میشود. سلولهای طحال برداشتهشده با سلولهای میلومایی (myeloma)ترکیب میشوند تا سلولهای هیبریدومایی تولید کنند که بهطور مداوم آنتیبادی ترشح میکنند. پس از غربالگری، سلولهای انتخابشده برای تولید آنتیبادیهای کایمریک یا انسانی استفاده میشوند.
نمایش فاژی
نمایش فاژی اولین و هنوز هم پرکاربردترین فناوری برای انتخاب آنتیبادی آزمایشگاهی است. در نمایش فاژی از تکنیکهای DNA نوترکیب برای ترکیب پپتیدهای خارجی با پروتئین پوششی (pIII) باکتریوفاژ “M13” بهمنظور نمایش پپتیدها برروی سطح باکتریوفاژ استفاده شد.
سپس «وکتورهای فاژی قابل انتخاب آنتیبادی» ایجاد شد و روشی را در شرایط “in vitro” توصیف کردند که براساس میل پیوندی آنتیبادیهای نمایش فاژی اختصاصی آنتیژن، آن آنتیژن را از بین 108 برابر فاژ اضافی انتخاب میکند. سپس کشف شد که “scFV” که فرمتهای کوچک آنتیبادی هستند و میتواند برروی رشتههای فاژی بیان شود. از آن زمان این کتابخانههای آنتیبادی نشاندادهشدهی فاژی ثابت کردند که یک پلتفرم قابل اعتماد برای شناسایی آنتیبادیهای منوکلونال قوی و بهطور کامل انسانی هستند.
تکنیک سلول B منفرد
از اهداکنندگان آلوده یا واکسینهشده، “PBMC” (سلولهای تک هستهای خون محیطی) برای جداسازی سلولهای B مناسب با فلوسایتومتری تهیه میشوند. با کمک “RT PCR” به اطلاعات “VH” و “VL” دست پیدا میکنیم و با کمک آنها آنتیبادی منوکلونال انسانی ساخته میشود.
حیوانات تراریخته
استفاده از حیوانات تراریخته فناوری دیگری برای بهدستآوردن آنتیبادیهای منوکلونال بهطور کامل انسانی است. ردههای موشی از نظر ژنتیکی اصلاح میشوند بهطوریکه ژنهای ایمونوگلوبین انسانی (Ig) به ژنوم وارد شدهاند و جایگزین ژنهای اندوژن (endogenous) Ig میشوند و این حیوانات قادر به سنتز آنتیبادیهای بهطور کامل انسانی پس از ایمنسازی میشوند.
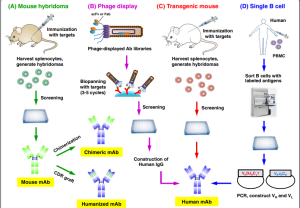
واکسن چیست؟
واکسن یک مادهی بیولوژیکی است که سیستم ایمنی را با واردکردن ارگانیسمی که باعث مرگ یا ضعف میزبان میشود، تحریک میکند. واکسنها میتوانند براساس پاتوژنهای ضعیفشده یا اجزای ارگانیسمهای کشتهشده تولید شوند. واکسنها ایمنی اکتسابی را در برابر یک بیماری خاص ایجاد میکنند. نحوه عملکرد واکسن یا پیشگیریکننده است (برای جلوگیری از عفونت آینده) یا میتواند درمانی باشد، بهویژه بسیاری از واکسنهای سرطان در مراحل آزمایشی هستند. واکسنهای سنتی شامل میکروارگانیسمهای کشتهشده یا ضعیفشدهای هستند که پس از واردشدن به بدن، پاسخهای ایمنی را در بدن ایجاد میکنند.
اصطلاح واکسن یا واکسیناسیون مشتقشده از “Variolae vaccinae” (آبله گاوی) برای اولین بار توسط یک پزشک انگلیسی بهنام ادوارد جنر (Edward Jenner) ابداع شد. او این اصطلاح را در سال 1798 برای آزمایشهای طولانی خود جهت ایجاد نقش محافظتی آبله گاوی در برابر آبله استفاده کرد.
طبق اعلام سازمان بهداشت جهانی تاکنون 25 واکسن دارای مجوز برای بیماریهای عفونی مختلف موجود است. پس از ظهور فناوری DNA نوترکیب که زیرمجموعهی بیوتکنولوژی است، اثرات مثبت قابلتوجهی بر سلامت انسان مشاهده شد.

واکسنها منجر به ترشح آنتیبادیها میشوند
پاسخ ایمنی اکتسابی توسط سلولهای B که آنتیبادی ترشح میکنند (ایمنی هومورال) و توسط سلولهای “T” (ایمنی سلولی) انجام میشود. همهی واکسنهایی که بهطور معمول استفاده میشوند، بهجز “BCG” (پاسخهای سلول T را القا میکند که از بیماری شدید جلوگیری میشود. همچنین پاسخهای ایمنی ذاتی را القا میکند که ممکن است عفونت را مهار کند) تصور میشود که اکثر آنها از طریق القای آنتیبادیها محافظت ایجاد میکنند. شواهد قابلتوجهی وجود دارد که انواع مختلف آنتیبادی عملکردی در حفاظت واکسنها مهم هستند.
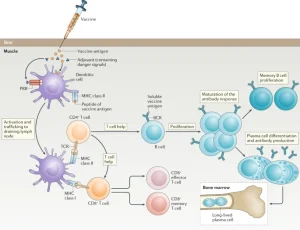
در شکل زیر، واکسن به عضله تزریق میشود و آنتیژن پروتئینی توسط سلولهای دندریتیک (dendritic cells) جذب میشود که از طریق گیرندههای شناساییکنندهی الگو (pattern recognition receptors) توسط سیگنالهای خطر موجود در ادجوانت (adjuvant) فعال میشوند و سپس به غدههای لنفاوی منتقل میشوند.
در اینجا، عرضهی پپتیدهای آنتیژن پروتئینی واکسن توسط مولکولهای “MHC” برروی سلول دندریتیک، سلولهای T را از طریق گیرندهی سلول T (TCR) فعال میکند. سلولهای T با سیگنالدهی (توسط آنتیژن محلول) از طریق گیرندهی سلول B (BCR) رشد سلول B را در غدد لنفاوی هدایت میکنند. توسعه سلول B وابستهبه سلول T منجر به بلوغ پاسخ آنتیبادی برای افزایش میل پیوندی (affinity) و القای ایزوتیپهای (isotypes) مختلف آنتیبادی میشود. سلولهای B خاطره (Memory B cells) نیز تولید میشوند.
واکسنهای نوین
بیوتکنولوژی انقلابی را در زمینهی زیست پزشکی ایجاد کردهاست. آنتیژن سطحی نوترکیب هپاتیت B (HBsAg) اولین واکسن نوترکیب کلونشدهبود و در سطح ساکارومایسس سرویزیه (Saccharomyces cerevisiae) بیان شد و در حال حاضر بهعنوان واکسن علیه “HBV” (hepatitis B virus) در سطح جهان استفاده میشود.
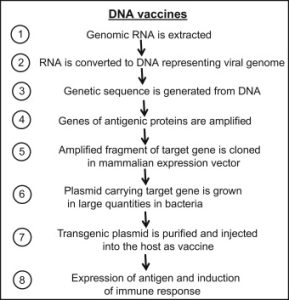
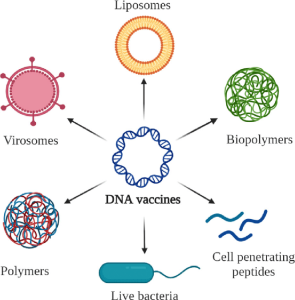
واکسنهای DNA بهصورت DNA مهندسیشدهی ژنتیکی هستند که وقتی تزریق میشوند، آنتیژن تولید میکنند و پاسخ ایمنی قوی را القا میکنند.
واکسن “mRNA” (Messenger RNA) واکسنولوژی معکوس و پلتفرمهای ژنتیکی معکوس هستند که در توسعهی انواع واکسنها استفاده میشوند و نتایج امیدوارکنندهای را نشان دادهاند.
انواع واکسنهای نوین
واکسن زیرواحدی نوترکیب (recombinant sub unit vaccine)
پس از کشف کلونکردن ژن (gene cloning) درهای جدیدی در زمینهی درمان باز شد. این یک تکنیک جدیدی است که از طریق کلونکردن پروتئین آنتیژنیک (قطعه) یا زیرنوع آن و کلونکردن حیوانی یا سایر سیستمهای بیانی برای رونویسی آن انجام میشود. پروتئین بیانی خالصشده به بدن تزریق میشود تا سیستم ایمنی را تحریک کند.
آنتیژن سطحی هپاتیت B نوترکیب (HBsAg) اولین واکسن نوترکیب بود که توسط موریس هلمن (Maurrice Hellmen) و تیمش با استفاده از تکنیکهای کلونکردن ساختهشد. HBsAg از سرم آلوده که ناقل HBV بود، تخلیص شد و سپس در ساکارومایسس سرویزیه کلون و بیان شد. HBsAg بیان و از کشت مخمر خالصسازی شد. حیوانات واکسینهشده (میمونها، شامپانزهها و موشها) پس از تزریق، نسبت به HBV مقاوم شدند.
واکسنهای DNA
واکسنهای دیاکسیریبونوکلئیکاسید (DNA) بهطور کلی DNA مهندسیشدهی ژنتیکی هستند که وقتی تزریق میشوند، آنتیژن تولید میکنند و پاسخ ایمنی قویای القا میکنند. ژن مسئول پاسخ ایمنی شناسایی میشود. سپس آن ژن کلونشده و با تزریق مستقیم آن در میزبان بیان میشود. واکسنهای DNA در مقایسه با واکسنهای زنده ضعیفشده یا کشتهشده، پتانسیل القای پاسخ ایمنی بالاتری دارند.
واکسنهای DNA در سال 1990 برای اولینبار ساختهشدند و DNA پلاسمید در عضله یا پوست تزریق شد و پاسخ ایمنی علیه ویروسی همراه با آنتیژنهای غیر ویروسی را القا کرد. تصور میشد که واکسنهای DNA آیندهی بسیار امیدوارکنندهای دارند، اما تاکنون هیچ واکسنی برای انسان مجوز FDA نگرفتهاست. فقط واکسنهای حیوانی مانند ملانوم سگسانان (canine melanoma) و واکسن برای ویروس نیل غربی (West Nile Virus) در اسبها در دسترس هستند.
واکسنولوژی معکوس (Reverse Vaccinology)
روشی جدید در واکسنشناسی که نقطهی اوج بیوانفورماتیک، ژنومیک و پروتئومیکس برای شناسایی ژنهای جدید در پاتوژن است که میتواند پاسخهای ایمنی را برانگیزد. این روش توسط “Rino Rappuloi” برای ساخت واکسنهای مننگوکوک (meningococcus) سروتیپ B (MenB) ساختهشدهاست. تلاشهای اولیه برای واکسنولوژی معکوس با توسعه واکسن “MenB” آغاز شد.
MenB بیش از 50 درصد مننژیت مننگوکوکی را ایجاد میکند و هیچ واکسنی بهدلیل ساختار استثنائی آن در دسترس نبود. پلیساکارید باکتریایی مشابه آنتیژن خودی انسانی است اما پروتئین سطحی بسیار متنوع است؛ بنابراین طراحی واکسن بسیار دشوار بود. بهمنظور دستیابی به این 600 آنتیژن ممکن، غربالگری و در باکتری اشریشیا کلی (E coli) بیان شد. قابلقبولترین پروتئینها برای نمونه اولیه واکسن پذیرفتهشد. سپس از لیپوساکارید بهعنوان ادجوانت استفاده شد و پاسخ ایمنی تقویتشده بهدست آمد.
مزیت اصلی واکسنولوژی معکوس این است که مقرونبهصرفه و سریع است اما تنها عیب آن این است که فقط پروتئینها را هدف قرار میدهد. در حالیکه واکسنولوژی مرسوم سایر اجزای زیست مولکولی مانند پلیساکاریدها را نیز هدف قرار میدهد.
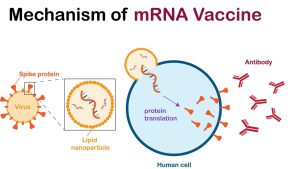
واکسن RNA پیامرسان (mRNA)
نقش RNA پیامرسان (mRNA) در سلول سنتز پروتئین (ترجمه) است. در واکسن mRNA، رشته پروتئینهای خاص بیماری را کد میکند و در سطح سلول بیان میشود. پس از بیان آنتیژن اختصاصی عامل بیماریزا در سطح سلول، پاسخ ایمنی ایجاد میشود. واکسن mRNA روشی جدید، ایمن و ارزانتر در مقایسه با واکسنهای معمولی است. استفاده از واکسنهای mRNA بهدلیل پایداری و سایر ویژگیهای فارماکولوژیک، چالشی برای دانشمندان باقیماندهاست.
پلتفرم ژنتیک معکوس (Reverse Genetics Platform)
ژنتیک معکوس در لغت بهمعنی درک اثر یک ژن با تجزیه و تحلیل فنوتیپیک توالی ژنی مهندسیشدهی خاص است. مهندسی معکوس روشی کم هزینه، موثر و راحت را در مقایسه با رویکرد مرسوم برای ایجاد واکسنهای زندهی ضعیفشده ارائه میکند. روش متداول برای تولید واکسن زندهی ضعیفشده، تولید پلاسمیدهایی با توالی کدکننده پروتئینهای ساختاری و عملکردی است. واکسن ویروس آنفولانزا حاوی هشت پلاسمید است که برای تولید واکسن ترانسفکت (transfect) شدهاند.
منابع:
https://www.ncbi.nlm.nih.gov/books/NBK207433/
https://pubmed.ncbi.nlm.nih.gov/7620975/
https://biomedres.us/fulltexts/BJSTR.MS.ID.005949.php
https://www.britannica.com/science/genetic-engineering/Process-and-techniques
https://www.britannica.com/technology/biotechnology/Applications-of-biotechnology
نویسنده: ریحانه ارفعی
ویراستار: حدیث پرهیزگاری

3 نظرها