فهرست مطالب
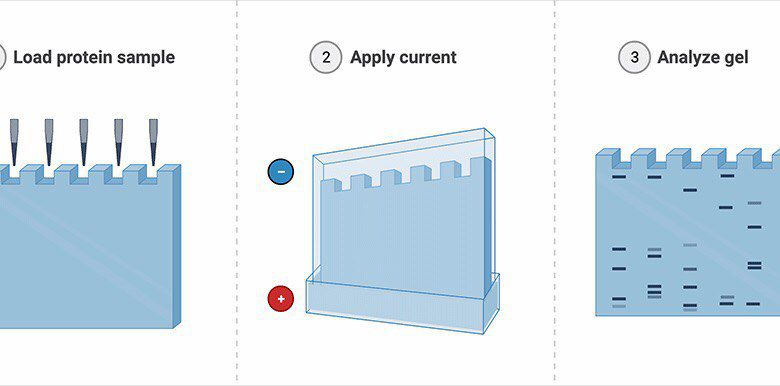
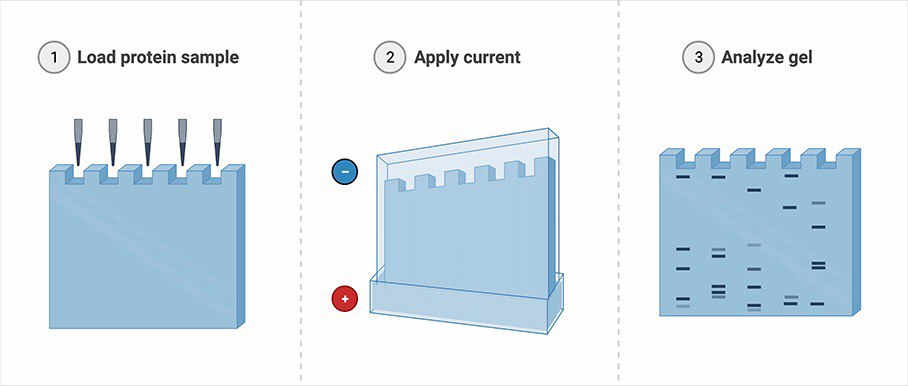
در تکنیک SDS–PAGE ،SDS-PAGE یا الکتروفورز ژل دودسیل سولفات – پلی آکریل آمید سدیم تکنیکی است که بیشتر در آزمایشگاههای ژنتیک، بیوتکنولوژی، بیوشیمی و زیستشناسی مولکولی برای جداسازی پروتئینها از یک نمونه مخلوط استفاده میشود که یک پروتئین واحد را از یک مخلوط شناسایی میکند. آنها پروتئینها را بر اساس تحرک الکتروفورتیک خود جدا میکنند که در آن تحرک مولکول با اندازه آن نسبت معکوس و با بار آن نسبت مستقیم دارد.
الکتروفورز ژل پلی آکریل آمید (PAGE) یکی از پرکاربردترین روشهای آزمایشگاهی برای جداسازی ماکرومولکولهای بیولوژیکی مانند پروتئینها و اسیدهای نوکلئیک است. ماکرومولکولها بر اساس تحرک الکتروفورز آنها که تابعی از طول، ساختار و بار مولکول است، متمایز میشوند.
به طور کلی، ماکرومولکولها ممکن است در حالت اصلی خود یا به شکلهای دناتوره شده اجرا شوند. برای جداسازی مولکولها بر اساس طول آنها، نمونهها در شرایط دناتوره اجرا میشوند. برای پروتئینها، سدیم دودسیل سولفات (SDS) برای خطی کردن پروتئینها و بار منفی پروتئینها استفاده میشود.
اتصال SDS به زنجیره پلی پپتیدی باعث توزیع یکنواخت بار در واحد جرم میشود. در نتیجه، پروتئینهای دارای بار منفی به سمت الکترود مثبت مهاجرت میکنند و در طول الکتروفورز با اندازه تقریبی تکه تکه میشوند. این روش SDS-PAGE نامیده میشود. وسترن بلات ترکیبی از SDS-PAGE و تشخیص مبتنی بر آنتی بادی است و یک برنامه کاربردی آنتی بادی است که معمولا برای شناسایی پروتئینها از مخلوطهای بیولوژیکی پیچیده استفاده میشود.
کاربرد تکنیک SDS – PAGE
کاربردهای تکنیک SDS – PAGE عبارتاند از:
- SDS – PAGE برای اندازه گیری وزن مولکولی مولکولهای پروتئین استفاده میشود.
- این تکنیک در نقشه برداری پپتید و در مقایسه ترکیب پپتید استفاده میشود.
- برای تخمین خلوص پروتئین و کمیت پروتئین استفاده میشود.
- در کاربرد پس از الکتروفورز استفاده میشود: وسترن بلاتینگ
- همچنین در تجزیه و تحلیل اصلاحات پس از ترجمه استفاده میشود.
اصل تکنیک SDS–PAGE
اصل تکنیک SDS–PAGE جداسازی پروتئینهای خاص به روش الکتروفورزی از مخلوطی از نمونهها بر اساس اندازه آنها با استفاده از ماتریس ژل پلی آکریل آمید است. آکریل آمید پلیمریزه شده (پلی آکریل آمید) یک ماتریس ژل مانند مناسب برای جداسازی پروتئینها است که محصول واکنش پلیمریزاسیون بین آکریل آمید و N, N’ –methylene-bis-acrylamide است. درجه اتصال عرضی تعیین کننده سختی و نرمی ژل است که با تنظیم غلظت آن میتوان آن را ساخت. هرچه اتصال بیشتر باشد، ژل سختتر خواهد بود که مهاجرت مولکولها را کندتر میکند. اما با ژل شل، مولکولها سریعتر میشوند.
SDS یک ماده شوینده آنیونی است که با نسبت مولی ثابت به ستون پروتئین متصل میشود و یک بار منفی تشکیل میدهد که پیوندهای دی سولفیدی پروتئینها را میشکند و ساختار سوم را مختل میکند و سپس پروتئین بر اساس طول زنجیره پلی پپتیدی آنها به روش الکتروفورزی جدا میشود.
روشSDS–PAGE
آماده سازی نمونه:
- نمونه پروتئین با حرارت دادن آنها با مواد شوینده SDS و 2- مرکاپتواتانول تا دناتوره شدن تهیه میشود.
- SDS به شدت به پروتئین متصل میشود و بار منفی تشکیل میدهد در حالی که 2- مرکاپتواتانول گروههای سولفیدریل را آزاد میکند که در آن زنجیرههای پلی پپتیدی با بار منفی اضافی مشابه نسبت جرم آزاد میشوند.
- با نمونه پروتئین، محلول بافر در لولههای میکروسانتریفیوژ اضافه میشود و به مدت 3 دقیقه در دمای 100 درجه سانتی گراد حرارت داده میشود.
- سپس لولهها با سرعت 15000 دور در دقیقه به مدت 1 دقیقه در دمای 4 درجه سانتی گراد سانتریفیوژ میشوند.
- مایع رویی بیشتر در فرآیندهای SDS – PAGE استفاده میشود.
تهیه ژل پلی آکریل آمید:
- برای تهیه یک ژل الکتروفورتیک، اجزای متعددی از جمله آکریل آمید، N، N’-متیلن-بیس آکریل آمید (BIS) و یک محلول بافر با هم مخلوط میشوند.
- در طی پلیمریزاسیون ژل، پرسولفات آمونیوم، یک منبع رادیکال آزاد و یک تثبیت کننده اضافه میشود و مخلوط گاز زدایی میشود یا بوتانول اضافه میشود تا از تشکیل حباب جلوگیری شود.
- یک شانه بین فضاهای صفحه شیشه ای قرار میگیرد و اجازه میدهد تا پلیمریزه شود.
- ژل پلیمریزه شده، gel cassette نامیده میشود.
الکتروفورز:
- نمونه دناتوره شده 30 میلی لیتری با پیپت خارج میشود و در چاه قرار میگیرد و اجازه میدهد تا حدود یک ساعت در 30 میلی آمپر کار کند.
- با اعمال جریان الکتریکی، مولکولهای پروتئینی با بار منفی از طریق ژل به سمت یک الکترود با بار مثبت مهاجرت میکنند.
- هر مولکول پروتئین نیز بر اساس اندازه مولکولی خود با سرعت متفاوتی مهاجرت میکند، یک مولکول کوچک با سرعت بیشتری نسبت به مولکولهای بزرگ حرکت میکند.
- ولتاژ بالا نیز سرعت مهاجرت را افزایش میدهد.
- برای جدا شدن کامل مولکولهای پروتئین، ممکن است حدود یک ساعت طول بکشد و سپس رنگ آمیزی و تجسم میشود.
رنگ آمیزی و تجسم:
- رنگهایی مانند Coomassie Brilliant Blue یا اتیدیوم بروماید برای رنگآمیزی ژل استفاده میشود که نوار رنگی مشخصی برای پروتئینها ایجاد میکند.
- استفاده از رنگهای رنگی غیر اختصاصی است، یعنی تمام پروتئینها را هدف قرار میدهد و این لکهها نیز غیر قابل برگشت هستند.
- این تجسم پروتئین غیر اختصاصی برای کمی سازی سریع نمونهها در ژل استفاده میشود.
- تجسم پروتئین خاص مستلزم استفاده از آنتی بادیهای کونژوگه با رنگ یا آنزیمی است که ساختار منحصر به فرد پروتئینها را تشخیص میدهد.
- وسترن بلات همچنین با تجسم پروتئین با انتقال پروتئینها از ژل به غشایی که میتواند با آنتی بادیها بررسی شود، مرتبط است.
- جرم مولکولی نمونه پروتئین ناشناخته با مقایسه مسافت طی شده توسط مولکولهای ناشناخته با نشانگر تعیین میشود.
مزایای استفاده از روش SDS–PAGE
- مهاجرت مولکولهای پروتئین متناسب با وزن مولکولی آن است.
- SDS – PAG یک آزمایش بسیار حساس است که مولکولهایی را که دارای حداقل (~2%) اختلاف جرمی هستند جدا میکند.
- حتی مقدار کمی از نمونه برای پردازش کافی است.
- DNA خالص را میتوان از ژل بازیابی کرد.
- اندازه منافذ ژل پلی آکریل آمید را میتوان با تنظیم غلظت دو مونومر کنترل کرد.
معایب استفاده از روش SDS–PAGE
- تهیه ژل اغلب دشوار است و زمان زیادی میبرد.
- مونومرهای مورد استفاده یک ماده شیمیایی نوروتوکسین قوی هستند.
- وضوح باند به دلیل PH بالای قلیایی عملکرد ضعیف است.
- برای هر آزمایش ژل جدید مورد نیاز است.
جمعبندی
تکنیک SDS – PAGE پرکاربردترین تکنیک برای جداسازی پروتئینها از نمونههای پیچیده مخلوط است و نقش کلیدی در زیست شناسی مولکولی و طیف وسیعی از زیرشاخههای تحقیقات بیولوژیکی ایفا میکند. در SDS-PAGE، ماده شوینده SDS و یک مرحله گرمایش مشخص میکند که تحرک الکتروفورتیک یک نوع پروتئین تنها تحت تأثیر وزن مولکولی آن در ژل آکریل آمید متخلخل است.
نویسنده: یاسمن اسمی
منابع:
1.https://thesciencenotes.com/sds-page/
2.http://www.assay-protocol.com/molecular-biology/electrophoresis/denaturing-page.html