
فهرست مطالب
شبیهسازی انسان به معنای ایجاد نسخههای ژنتیکی یکسان از انسان است. فرآیند شبیهسازی انسان سؤالات اخلاقی بسیاری را مطرح میکند و بهشدت بحثبرانگیز است؛ درحالیکه ایدهی شبیهسازی انسان ممکن است چیزی خارج از داستان علمی-تخیلی به نظر برسد، در گذشته تلاشهای قابل توجهی برای شبیهسازی انسان صورت گرفته و منجر به بحثهای زیادی در مورد پیامدهای شبیهسازی انسان، هم برای افراد و هم برای جامعه شدهاست؛ علیرغم نگرانیهای اخلاقی پیرامون شبیهسازی انسان، مزایای بالقوهای نیز وجود دارد که میتوان از این فناوری به دست آورد، مانند توانایی پیوند اعضای بدن و درمان بیماریهای خاص.

تاریخچهی شبیهسازی انسان
ایدهی شبیهسازی انسان برای ایجاد یک کپی ژنتیکی یکسان از یک شخص، به دوران باستان بازمیگردد؛ جایی که داستانهای اسطورهای اغلب شامل خلق انسان از مواد غیرانسانی میشد. با این حال، در قرن بیستم پیشرفتهای علمی، راه را برای امکان شبیهسازی انسان هموار کرد.
در سال ۱۹۳۸، “Hans Spemann” جنینشناس آلمانی، نظریه «انتقال هستهای» را ارائه کرد که شامل پیوند یک هستهی سلول به یک تخمک بارورنشده برای ایجاد یک کلون بود؛ با این حال، کاربردهای عملی به دلیل محدودیتهای تکنولوژی تا اواخر قرن بیستم محدود بود.
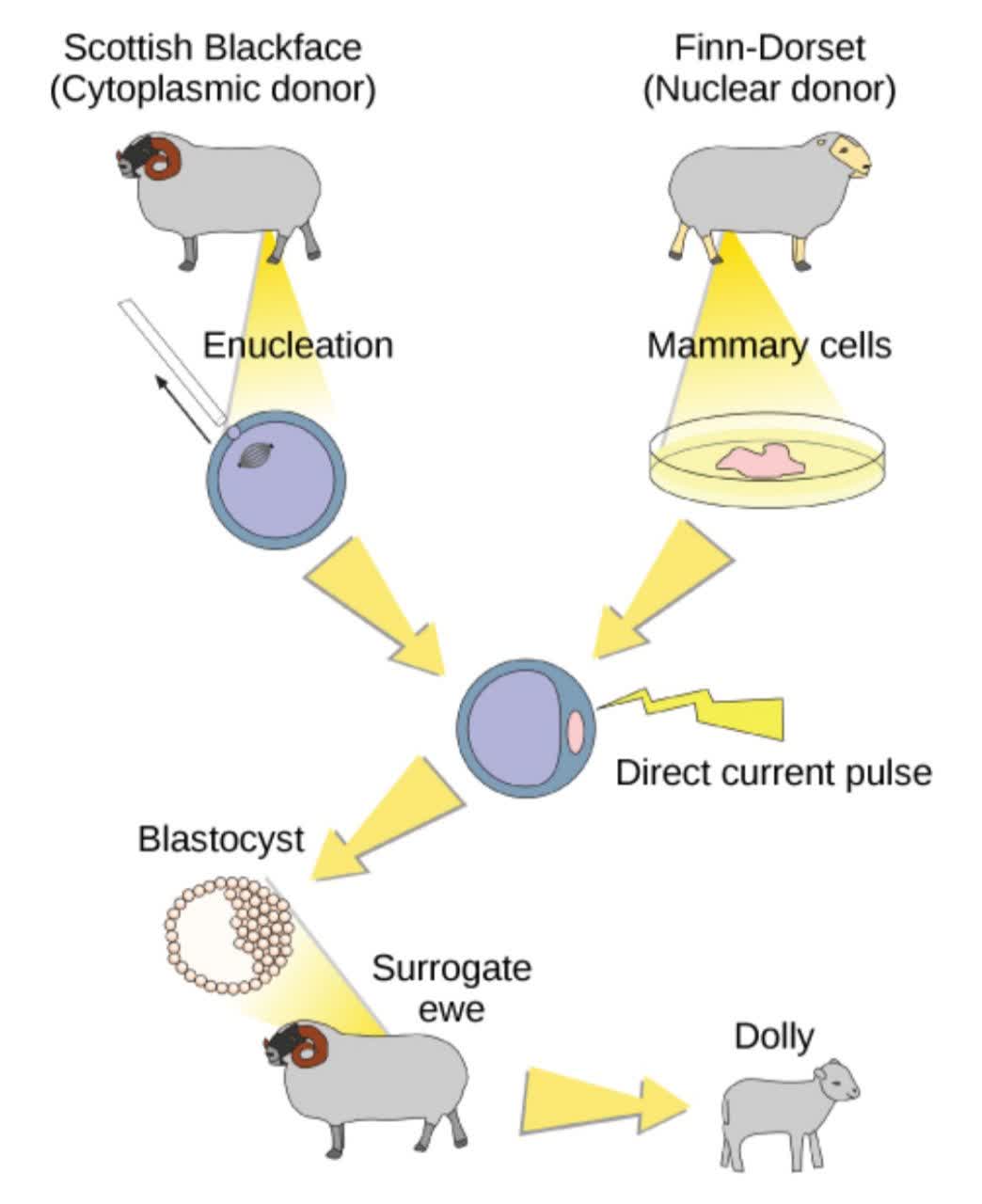
در سال ۱۹۹۶، زمانی که دانشمندان اسکاتلندی با موفقیت گوسفندی به نام «دالی» را شبیهسازی کردند، یک پیشرفت مهم رخ داد. این اولین تکرار موفقیتآمیز یک پستاندار با استفاده از سلولهای بالغ بود. ایجاد دالی از طریق فرآیندی به نام انتقال هستهای سلولهای سوماتیک (SCNT) انجام شد، جایی که هستهی یک سلول بالغ با حذف هستهی اولیه به تخمک منتقل شد.
دالی، شبیهسازی انسان را در کانون توجه قرار داد و نگرانیهای اخلاقی و بحثهای قانونی را برانگیخت. بسیاری از کشورها قوانین و مقرراتی را برای محدودکردن یا ممنوعکردن شبیهسازی انسان وضع کردند؛ به عنوان مثال، کنگرهی ایالاتمتحده قانون منع شبیهسازی انسان را در سال ۲۰۰۱ تصویب کرد و شبیهسازی انسان را غیرقانونی اعلام کرد.
با این حال، علاقه به شبیهسازی انسان در جامعهی علمی ادامه یافت. در سال ۲۰۱۳، محققان دانشگاه علوم و بهداشت “Oregon” با موفقیت سلولهای بنیادی جنینی انسان را شبیهسازی کردند و این فناوری دانشمندان را به علم شبیهسازی انسان یک قدم نزدیکتر کرد. این پیشرفتها در تحقیقات سلولهای بنیادی، راه را برای کاربردهای پزشکی بالقوهی شبیهسازی، از جمله توانایی رشد اندامها برای پیوند بدون خطر، هموار کرد.
از آن زمان، تمرکز تحقیقات شبیهسازی انسانی بیشتر به سمت شبیهسازی درمانی، به جای شبیهسازی تولیدمثلی، معطوف شدهاست. هدف شبیهسازی درمانی ایجاد سلولهای بنیادی جنینی برای استفاده در درمانهای پزشکی و تحقیقات بیماری است. دانشمندان امیدوارند با ایجاد سلولهای بنیادی همسان ژنتیکی، بتوانند درمانهای شخصیسازیشده برای بیماریهایی مانند پارکینسون، آلزایمر و آسیبهای نخاعی ایجاد کنند.

شبیهسازی (Cloning)
شبیهسازی که به آن «کلونینگ» گفته میشود، از ریشهی «کلون» است که یک واژهی یونانی است و معنای لغوی آن «جوانهزدن و تکثیرکردن» است. کلونینگ در علم زیستشناسی عبارت است از «تکثیر موجود زنده بدون آمیزش جنسی» و در حال حاضر، به عمل کاشت جنینی در رحم اطلاق میشود که ابتدا در آزمایشگاه تولید شده باشد؛ فرآیند آن به این ترتیب است که محققان ابتدا هستههای یک تخمک را با “DNA” سلولهای دیگر جایگزین نموده، سپس تخمک بازسازیشده را در آزمایشگاه مورد مراقبت قرار میدهند تا تقسیم شده و به جنین تبدیل شود. چنانچه جنین مزبور در رحم کاشته شود و از آن انسانی به وجود آید، شبیهسازی مولد انسان صورت گرفتهاست.
انواع شبیهسازی انسان
انواع شبیهسازی انسان عبارتند از:
شبیهسازی تولیدمثلی (Reproductive cloning)
“Reproductive cloning” فرآیند ایجاد افرادی است که از نظر ژنتیکی یکسان هستند که شامل لانهگزینی یک جنین شبیهسازیشده در رحم واقعی یا مصنوعی است. شبیهسازی تولیدمثلی، نسخههایی از حیوانات کامل تولید میکند و امروزه شکل غالب شبیهسازی حیوانات است. کلونها حاوی مجموعههای یکسانی از مواد ژنتیکی در هستهی هر سلول در بدن خود هستند، بنابراین سلولهای دو کلون دارای DNA یکسان و ژنهای یکسان در هستهی خود هستند. شبیهسازی تولیدمثلی انسان، شامل ایجاد انسانی است که از نظر ژنتیکی با فرد دیگری که قبل از آن وجود داشته یا هنوز وجود دارد، یکسان است.
در بسیاری از کشورها، قوانینی وجود دارد که استفاده از شبیهسازی و مهندسی ژنتیک را بهعنوان روشهای تولیدمثل انسان، منع میکند. شبیهسازی تولیدمثلی با استفاده از انسان بهعنوان وسیلهای برای رسیدن به هدف، ایجاد امکان برای سوءاستفاده و اجازهی انتخاب اصلاحنژادی، نگرانیهای اخلاقی را ایجاد میکند. شبیهسازی انسان یک روش خطرناک و ناقص است و کپی دقیقی از یک فرد ایجاد نمیکند. با وجود امکان شبیهسازی انسان، دانشمندان هنوز یک فرد کامل را شبیهسازی نکردهاند و ملاحظات بیولوژیکی، اخلاقی و اجتماعی زیادی وجود دارد که شبیهسازی انسان را به موضوعی بحثبرانگیز تبدیل میکند.
شبیهسازی درمانی (Therapeutic Cloning)
یکی دیگر از انواع شبیهسازی انسان، شبیهسازی درمانی است که یک تکنیک علمی است که شامل ایجاد جنینهای شبیهسازیشده بهمنظور بهدستآوردن سلولهای بنیادی جنینی است. از این سلولهای بنیادی میتوان برای تولید بافتها یا اندامهایی استفاده کرد که از نظر ژنتیکی با بیمار یکسان هستند و بهطور بالقوه راههای جدیدی را برای پزشکی احیاکننده و درمانهای شخصی ارائه میدهند.
فرآیند شبیهسازی درمانی با گرفتن یک تخمک بارورنشده و برداشتن هستهی آن آغاز میشود؛ سپس یک هسته از یک سلول سوماتیک (هر سلولی در بدن به غیر از سلول تولیدمثلی) به تخمک وارد میشود. این تخمک، DNA سلول سوماتیک است و جنینی را ایجاد میکند که از نظر ژنتیکی یکسان است؛ پس از آن، تخمک در معرض محرکهای شیمیایی یا الکتریکی مختلف قرار میگیرد تا تقسیم و توسعهی سلولی آغاز شود. پس از چند روز، یک بلاستوسیست تشکیل شده و در نهایت جفت را تشکیل میدهد.
این سلولهای بنیادی جنینی توانایی تمایز به هر نوع سلولی در بدن انسان را دارند و برای اهداف درمانی ارزشمند هستند. با ارائهی سیگنالها و شرایط مناسب، دانشمندان میتوانند این سلولهای بنیادی را برای تمایز به انواع سلولهای خاص، مانند سلولهای عصبی، سلولهای قلب یا سلولهای پانکراس تحریک کنند.
کاربردهای بالقوه شبیهسازی درمانی بسیار گسترده است. یکی از اهداف اولیهی استفاده از این سلولهای بنیادی، تولید بافت یا اندام برای پیوند است. از آنجایی که بافتهای بهدستآمده از نظر ژنتیکی با بیمار یکسان هستند، خطر پسزدن به حداقل میرسد و نیاز به داروهای سرکوبکنندهی سیستم ایمنی را از بین میبرد.
شبیهسازی درمانی نویدبخش توسعهی مدلهای بیماری، آزمایش دارو و مطالعهی توسعهی انسانی است. با ایجاد جنینهای شبیهسازیشده با بیماریهای ژنتیکی، دانشمندان میتوانند پیشرفت این بیماریها را مطالعه کرده و درمانهای بالقوه را در یک محیط آزمایشگاهی کنترلشده، آزمایش کنند. علیرغم مزایای بالقوهی آن، شبیهسازی درمانی به دلیل نگرانیهای اخلاقی، موضوعی بحثبرانگیز است. منتقدان معتقدند که ایجاد و ازبینبردن جنینهای شبیهسازیشده برای اهداف تحقیقاتی، مسائل اخلاقی مرتبط با وضعیت جنین و تقدس زندگی انسان را مطرح میکند.
توجه به این نکته در شبیهسازی انسان مهم است که شبیهسازی درمانی از شبیهسازی تولیدمثلی متمایز است. شبیهسازی درمانی شامل شبیهسازی سلولهای انسان برای استفاده در پزشکی و پیوند میشود و یک حوزهی تحقیقاتی فعال است؛ اما شبیهسازی تولیدمثلی به جای ساختن سلولها یا بافتهای خاص، هدف آن ایجاد یک فرد شبیهسازیشده است. شبیهسازی تولیدمثلی شامل کاشت یک جنین شبیهسازیشده در یک مادر جایگزین با هدف تولید یک انسان زنده است. این حوزه از شبیهسازی چالشهای اخلاقی، اجتماعی و عملی بیشتری را ایجاد میکند و در حال حاضر در بسیاری از کشورها ممنوع است.
شبیهسازی ژن (Gene cloning)
شبیهسازی ژن که بهعنوان شبیهسازی DNA یا شبیهسازی مولکولی شناخته میشود، یک تکنیک قدرتمند است که در بیوتکنولوژی و ژنتیک برای تولید چندین نسخه از یک ژن یا توالی خاص DNA استفاده میشود. فرآیند شبیهسازی ژن شامل چندین مرحلهی اساسی است.
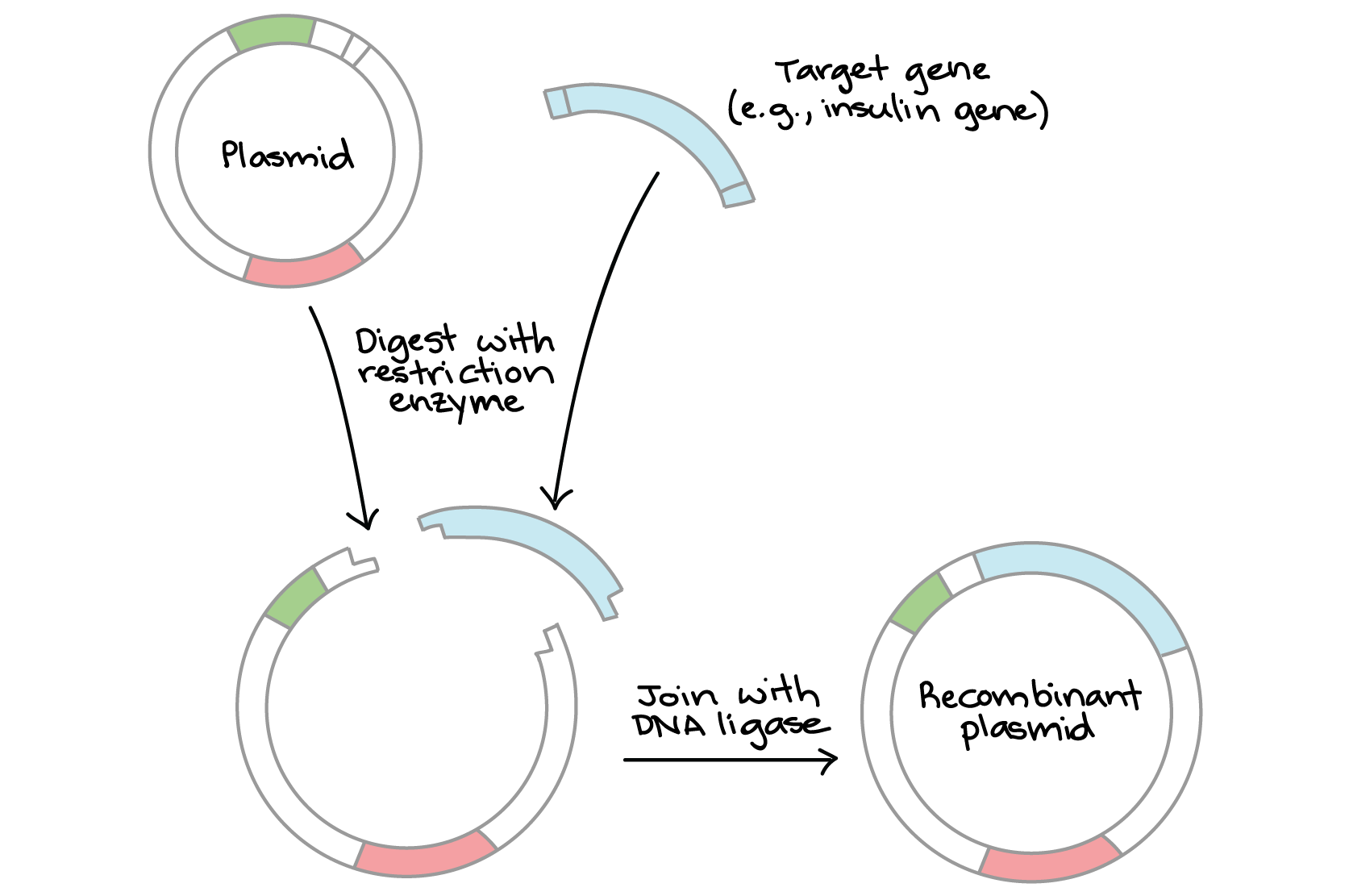
در ابتدا، ژن مورد نظر باید شناسایی و از ژنوم ارگانیسم جدا شود. این امر از طریق برش DNA با استفاده از آنزیمهای محدودکننده حاصل میشود که آنزیمهایی هستند که توالیهای DNA خاص را تشخیص میدهند و DNA را در این نقاط میشکافند؛ سپس قطعه DNA حاوی ژن مورد نظر در یک مولکول کوچک و دایرهای به نام پلاسمید قرار میگیرد که بهعنوان یک ناقل عمل میکند. پلاسمیدها بهطور معمول از باکتریها به دست میآیند و میتوانند بهطور مستقل در آنها تکثیر شوند.
پس از واردشدن ژن به پلاسمید، آن را به ارگانیسم میزبان (اغلب باکتری) وارد میکنند. این به ارگانیسم میزبان امکان تکثیر و بیان ژن شبیهسازیشده را میدهد؛ سپس سلولهای تبدیلشده در یک محیط کنترلشده مانند پتریدیش یا بیوراکتور برای بیان و تکثیر ژن کشت میشوند. در نهایت، ژن شبیهسازیشده و خالصشده را میتوان آنالیز کرد، در کاربردهای مختلف مورد استفاده قرار داد یا بیشتر برای اهداف تحقیقاتی دستکاری کرد.
اهمیت شبیهسازی ژن را نمیتوان انکار کرد؛ زیرا چندین زمینهی علمی را متحول میکند. در تحقیقات پزشکی، امکان تولید پروتئینهای درمانی، آنزیمها و هورمونها را فراهم میکند که برای درمان بیماریهای مختلف ضروری هستند. یکی از نمونههای بارز، تولید انسولین انسانی با استفاده از تکنیکهای شبیهسازی ژن است که زندگی میلیونها فرد مبتلا به دیابت را متحول کردهاست. شبیهسازی ژن، مطالعهی عملکرد و تنظیم ژن را امکانپذیر میکند. با شبیهسازی یک ژن خاص، دانشمندان میتوانند نقش آن را در فرآیندهای مختلف بیولوژیکی، توسعه یا مکانیسمهای بیماری بررسی کنند. درک شبیهسازی انسان برای توسعهی درمانها و رویکردهای جدید در پزشکی بسیار مهم است.
با این حال، شبیهسازی ژن بدون چالش نیست. این فرآیند به تخصص فنی، دقت و منابع قابل توجهی نیاز دارد. اطمینان از قرارگرفتن ژن مورد نظر در پلاسمید نیازمند توجه دقیق است؛ زیرا یک اشتباه میتواند نتایج ناخواستهای بههمراه داشته باشد. علاوهبر این، شناسایی ارگانیسم میزبان و بهینهسازی شرایط برای بیان ژن میتواند پیچیده باشد و نیاز به آزمایش و عیبیابی گسترده دارد.
آیندهی شبیهسازی ژن نویدبخش است. پیشرفتها در فناوریهای ویرایش ژن مانند “CRISPR Cas9″، شبیهسازی ژن را دقیقتر، کارآمدتر و در دسترستر کردهاست. این روش به دانشمندان اجازه میدهد تا بهطور انتخابی توالیهای DNA را اصلاح کنند و درهایی را به روی درمانهای بالقوه اختلالات ژنتیکی باز کنند.
انواع روشهای شبیهسازی انسان
انواع روشهای شبیهسازی انسان عبارتند از:
انتقال هستهی سلول سوماتیک (Somatic cell nuclear transfer)
انتقال هستهی سلول سوماتیک (SCNT) یک فرآیند پیچیده است که بهطور معمول در زمینهی فناوری تولیدمثل مورد استفاده قرار میگیرد که شامل پیوند هسته از یک سلول سوماتیک به یک سلول تخمکی است که هستهی آن برداشته شدهاست. این تکنیک جذاب کاربردهای متعددی دارد؛ از شبیهسازی درمانی برای تحقیقات پزشکی گرفته تا شبیهسازی تولیدمثلی برای حفظ گونهها. درحالیکه شبیهسازی انسان پتانسیل قابل توجهی برای پیشرفتهای علمی نشان دادهاست، نگرانیهای اخلاقی را نیز مطرح میکند و بحثهایی را در مورد استفاده از آن ایجاد میکند.
فرآیند “SCNT” با جمعآوری یک سلول سوماتیک شروع میشود. این سلول براساس ویژگیهای تخصصی آن انتخاب میشود؛ زیرا حامل اطلاعات ژنتیکی خاص فردی است که از سلولهایش استفاده میشود؛ سپس یک سلول تخمکی به دست میآید و هستهی آن خارج میشود و تنها سیتوپلاسم باقی میماند؛ پس از آن، هستهی سلول سوماتیک به داخل سلول تخمک خالی تزریق میشود و در نتیجه جنین بازسازیشده، ایجاد میشود. بسته به کاربرد مورد نظر روش SCNT، میتوان این جنین را دستکاری کرد تا به انواع سلولهای خاص تبدیل شود یا به یک مادر جایگزین منتقل شود.
یکی از کاربردهای اصلی SCNT شبیهسازی درمانی است که شامل تولید سلولهای بنیادی جنینی میشود و دارای ساختار ژنتیکی مشابه سلولهای جسمی فرد هستند. این سلولهای بنیادی میتوانند به انواع سلولهای خاص تبدیل شوند و منبع بالقوهای برای تولید بافتها یا اندامها برای پیوند یا پزشکی بازسازی شوند. این تکنیک نویدبخش درمان بیماریها و شرایط پزشکی مختلف است؛ زیرا میتواند سلولهای آسیبدیده یا بیمار را با سلولهای سالم و همسان ژنتیکی جایگزین کند.
با این حال،SCNT همچنین کاربردهای بحثبرانگیزی دارد، به ویژه در حوزهی شبیهسازی تولیدمثل. شبیهسازی تولیدمثلی بهدنبال ایجاد ارگانیسمی است که از نظر ژنتیکی با ارگانیسم موجود دیگر یکسان باشد. این نگرانیهای اخلاقی را در مورد دستکاری زندگی و سوءاستفاده احتمالی از این فناوری ایجاد میکند؛ برای مثال، مفهوم شبیهسازی انسان، بحثهایی را در مورد نقض فرآیندهای تولیدمثل طبیعی، فردیت و خطرات بالقوه مرتبط با چنین اعمالی برانگیخته است. علاوهبر نگرانیهای اخلاقی، SCNT با چالشهای فنی قابل توجهی نیز مواجه است. میزان موفقیت این روش پایین است؛ زیرا به دستکاری دقیق سلولهای ظریف و هماهنگی فرآیندهای بیولوژیکی پیچیده نیاز دارد. علاوهبر این، با گزارشهایی مبنی بر افزایش نرخ ناهنجاریها و کاهش طول عمر، سلامت حیوانات شبیهسازیشده اغلب به خطر افتادهاست.
سلولهای بنیادی پرتوان القایی (Induced pluripotent stem cells)
سلولهای بنیادی پرتوان القایی (iPSCs) یک کشف پیشگامانه در زمینهی تحقیقات سلولهای بنیادی است. این سلولها توانایی قابل توجهی برای تمایز به هر نوع سلولی در بدن انسان دارند و پتانسیل بسیار زیادی را برای پزشکی احیاکننده و مدلسازی بیماریها ارائه میدهند. سلولهای بنیادی پرتوان القایی از سلولهای سوماتیک بالغ، مانند سلولهای پوست یا سلولهای خونی، از طریق فرآیندی به نام “Reprogramming” مشتق میشوند.
یکی از برجستهترین کاربردهای سلولهای بنیادی پرتوان القایی در پزشکی احیاکننده است. با تمایز سلولهای بنیادی پرتوان القایی به انواع سلولهای خاص، دانشمندان بهطور بالقوه میتوانند بافتها یا اندامهای جایگزینی را برای درمان بیماریها و آسیبهای مختلف تولید کنند؛ بهعنوان مثال، سلولهای بنیادی پرتوان القایی را میتوان برای تولید سلولهای عضله قلب کارآمد برای ترمیم بافت آسیبدیدهی قلب یا سلولهای پانکراس برای درمان دیابت استفاده کرد.
یکی دیگر از مزایای قابل توجه سلولهای بنیادی پرتوان القایی پتانسیل آنها برای مدلسازی بیماری است. با تولید iPSC از بیماران مبتلا به بیماریهای خاص، محققان میتوانند مکانیسمهای زمینهای این بیماریها را در یک محیط آزمایشگاهی کنترلشده مطالعه کنند. این، امکان توسعهی درمانهای شخصی و آزمایش داروهای جدید را قبل از تجویز آنها به بیماران فراهم میکند. سلولهای بنیادی پرتوان القایی در گذشته با موفقیت برای مدلسازی بیماریهای تخریبکنندهی عصبی مانند پارکینسون و آلزایمر مورد استفاده قرار گرفتهاند و بینشهای ارزشمندی را در مورد پیشرفت بیماری و اهداف درمانی بالقوه ارائه میدهند.
علیرغم پتانسیل بسیار زیاد آنها، چندین چالش پیرامون تحقیقات iPSC وجود دارد. یکی از نگرانیهای اصلی خطر تشکیل تومور است. نشان داده شدهاست که سلولهای بنیادی پرتوان القایی توانایی خود را بهطور نامحدود تجدید میکنند که منجر به رشد کنترلنشده و تشکیل تومورها میشود. محققان بهطور فعال روی روشهایی برای بهبود ایمنی و کارایی تولید iPSC کار میکنند؛ مانند تنظیم دقیق فرآیند برنامهریزی مجدد یا استفاده از تکنیکهای پیشرفته مهندسی ژنتیک برای ازبینبردن خطر تشکیل تومور.
علاوهبر پزشکی احیاکننده و مدلسازی بیماری، سلولهای بنیادی پرتوان القایی پتانسیل ایجاد انقلابی در زمینهی کشف دارو را دارند. روشهای آزمایش سنتی دارو اغلب نمیتوانند شرایط فیزیولوژیکی انسان را بهطور کامل نشان دهند که منجر به نرخ بالای شکست دارو میشود. با سلولهای بنیادی پرتوان القایی، ایجاد مدلهای سلولی خاص بیماری و آزمایش اثربخشی و سمیت داروها به روشی دقیقتر امکانپذیر میشود. این رویکرد شخصی منجر به تولید داروهای ایمنتر و مؤثرتر میشود.
علاوهبر این، سلولهای بنیادی پرتوان القایی میتوانند به پزشکی شخصی کمک کنند. با تولید iPSC از بیماران، محققان میتوانند مدلهایی ایجاد کنند که شباهت زیادی به ساختار ژنتیکی بیمار دارند. این موضوع درک عمیقتر بیماریهای ارثی و توسعهی بالقوهی درمانهای متناسب را فراهم میکند. با سلولهای بنیادی پرتوان القایی، ممکن است پیشبینی پاسخهای فردی به درمانهای خاص، افزایش اثربخشی و بهحداقلرساندن واکنشهای جانبی امکانپذیر شود. یکی از محدودیتهای تحقیقات iPSC، پیچیدگی تمایز سلولهای بنیادی پرتوان القایی به انواع سلولهای خاص است. فرآیند برنامهریزی مجدد گاهی اوقات میتواند منجر به برنامهریزی مجدد ناقص شود. محققان بهطور مستمر در تلاش برای بهبود پروتکلهای تمایز برای اطمینان از تولید جمعیتهای سلولی با کیفیت بالا و قابل اعتماد هستند.
اخلاق زیستی
مزایا و معایب شبیهسازی انسان عبارتند از:
مزایای شبیهسازی انسان
پیشرفت در پزشکی و تحقیقات
شبیهسازی انسان میتواند به پیشرفتهای قابل توجهی در پزشکی و تحقیقات علمی منجر شود. شبیهسازی میتواند منبعی از سلولهای بنیادی جنینی برای مطالعهی بیماریها، توسعهی درمانهای جدید و بهطور بالقوه بازسازی بافتهای آسیبدیده فراهم کند.
گزینههای باروری و درمان ناباروری
شبیهسازی انسان گزینههای بالقوه باروری را برای افراد و زوجهایی که با ناباروری دستوپنجه نرم میکنند، ارائه میدهد. این میتواند یک روش جایگزین برای تولیدمثل ارائه دهد و به کسانی که نمیتوانند بهطور طبیعی باردار شوند، اجازه میدهد فرزندانی مرتبط ژنتیکی داشته باشند.
حفاظت از گونههای در حال انقراض
شبیهسازی پتانسیل کمک به حفاظت از گونههای در معرض خطر را دارد. با شبیهسازی حیوانات در معرض خطر، دانشمندان میتوانند تنوع ژنتیکی را حفظ کرده و از انقراض گونههای خاص جلوگیری کنند.
معایب شبیهسازی انسان
نقض نظم طبیعی و کرامت انسانی
منتقدان استدلال میکنند که شبیهسازی در نظم طبیعی تولیدمثل تداخل میکند و منحصربهفردبودن و منزلت موجودات فردی را تضعیف میکند. شبیهسازی بهعنوان یک دستکاری غیرطبیعی در زندگی تلقی میشود که برخلاف ارزش و قداست ذاتی موجودات زنده است. شبیهسازی انسان نگرانیهایی را در مورد کرامت زندگی انسان ایجاد میکند. ماده ۱۱ اعلامیهی جهانی یونسکو در مورد ژنوم انسان و حقوق بشر تصریح میکند که شبیهسازی تولیدمثلی انسانها مغایر با کرامت انسانی است.
پتانسیل برای استثمار و سوءاستفاده
شبیهسازی انسان نگرانیهایی را در مورد احتمال بهرهبرداری و سوءاستفاده ایجاد میکند. توانایی ایجاد نسخههای ژنتیکی یکسان از افراد میتواند برای اهداف غیراخلاقی مانند ایجاد کلونهایی برای برداشت اعضای بدن یا ایجاد ارتشهایی از سربازان شبیهسازی شده، مورد سوءاستفاده قرار گیرد.
عدم تنوع ژنتیکی
شبیهسازی انسان باعث کاهش تنوع ژنتیکی میشود که برای بقا و سازگاری گونهها ضروری است. فقدان تنوع ژنتیکی آسیبپذیری موجودات را در برابر بیماریها، تغییرات محیطی و سایر چالشها افزایش میدهد.
نویسنده و ویراستار: حدیث پرهیزگاری
منابع:
Isa NM, Hj Safian Shuri MF. Ethical Concerns About Human Genetic Enhancement in the Malay Science Fiction Novels. Sci Eng Ethics. 2018 Feb;24(1):109-127. doi: 10.1007/s11948-017-9887-1. Epub 2017 Mar 9. PMID: 28281149; PMCID: PMC7088815.
Ayala, F. J. (2015). Cloning humans? Biological, ethical, and social considerations. Proceedings of the National Academy of Sciences, 112(29), 8879-8886.
Klinger B, Schnieke A. 25th ANNIVERSARY OF CLONING BY SOMATIC-CELL NUCLEAR TRANSFER Twenty-five years after Dolly: how far have we come? Reproduction. 2021 Jun 16;162(1):F1-F10. doi: 10.1530/REP-20-0652. PMID: 33955849.
National Research Council. (2002). Scientific and medical aspects of human reproductive cloning. National Academies Press.
Volarevic V, Markovic BS, Gazdic M, Volarevic A, Jovicic N, Arsenijevic N, Armstrong L, Djonov V, Lako M, Stojkovic M. Ethical and Safety Issues of Stem Cell-Based Therapy. Int J Med Sci. 2018 Jan 1;15(1):36-45. doi: 10.7150/ijms.21666. PMID: 29333086; PMCID: PMC5765738.
Kfoury C. Therapeutic cloning: promises and issues. Mcgill J Med. 2007 Jul;10(2):112-20. PMID: 18523539; PMCID: PMC2323472.
Matoba S, Zhang Y. Somatic Cell Nuclear Transfer Reprogramming: Mechanisms and Applications. Cell Stem Cell. 2018 Oct 4;23(4):471-485. doi: 10.1016/j.stem.2018.06.018. Epub 2018 Jul 19. PMID: 30033121; PMCID: PMC6173619.
Bilousova G, Roop DR. Induced pluripotent stem cells in dermatology: potentials, advances, and limitations. Cold Spring Harb Perspect Med. 2014 Nov 3;4(11):a015164. doi: 10.1101/cshperspect.a015164. PMID: 25368014; PMCID: PMC4208713.
Bragança J, Lopes JA, Mendes-Silva L, Almeida Santos JM. Induced pluripotent stem cells, a giant leap for mankind therapeutic applications. World J Stem Cells. 2019 Jul 26;11(7):421-430. doi: 10.4252/wjsc.v11.i7.421. PMID: 31396369; PMCID: PMC6682501.
https://www.khanacademy.org/science/ap-biology/gene-expression-and-regulation/biotechnology/a/overview-dna-cloning
