فهرست مطالب
جواد عرب پور
دانشجوی کارشناسی میکروبیولوژی دانشگاه آزاد اسلامی واحد علوم پزشکی تهران (هماگلوتینین )
چکیده
هماگلوتینین (HA) یک عامل اصلی تعیین کننده بیماریزایی ویروس های آنفلوانزا A است. این بیماری با اتصال به گیرنده های سطح سلول و با ایجاد فیوژن غشایی باعث عفونت می شود.
این گلیکو پروتئین شامل محل های آنتی ژنی شناخته شده توسط سیستم ایمنی بدن میزبان ، محل های برش خورده شده توسط پروتئازهای میزبان ، محل های اتصال گیرنده های اتصال به گیرنده های سیالیل بر روی سلول هدف و پپتیدهای واسط فیوژن غشاء می باشد.[1, 2] تغییر در یک اسید آمینه در این محل ها ممکن است پتانسیل عفونت ویروس را تحت تأثیر قرار داده و در داخل و بین میزبان گسترش یابد.
ویروس های آنفلوانزا با H1 HA به پرندگان ، خوک ها و انسان ها آلوده شده و باعث ایجاد دو مورد از این چهار بیماری در 100 سال گذشته شده است : بیماری همه گیر در سال 1918 که منجر به کشته شدن 21 تا 50 میلیون نفر و بیماری همه گیر در سال 2009 شد که باعث بیش از 18000 کشته شد. درک رابطه بین ساختار آنتی ژن و خاصیت ایمنی ، ویژگی اتصال دهنده گیرنده در انتقال ویروس ، چگونگی کنترل محل برش بیماری زایی ، و اینکه چگونه پپتید فیوژن باعث فیوژن غشایی برای ورود ویروس آنفلوانزا به سلول میزبان می شود ، راههای مؤثرتری را برای جلوگیری و کنترل آنفلوانزا را به نشان خواهد داد.[3]
کلمات کلیدی : هماگلوتینین ، آنفولانزا ، فیوژن
مقدمه
ویروس آنفولانزا یکی از مرگبارترین ویروس هایی است که طی سالها جمعیت انسان را تهدید کرده است. قدرت همه گیری و شیوع ویروس آنفولانزا عامل بقاء آن و از مهمترین دلایل مرگبار بودن این ویروس است. این ویروس یکی از پاتوژن های مهم دستگاه تنفسی است. اين ويروس هر ساله 5-3 میلیون نفر را در سراسر جهان مبتلا می کند که در موارد شدید، منجر به مرگ 250 تا350 هزار نفر می شود.[4] نوزادان ، افراد مسن و افراد با نقص سيستم ایمنی نسبت به عفونت آنفلوانزا بیشتر در معرض خطر قرار دارند. تا به امروز پنج تیپ ایمونولوژیکی از ویروس آنفلوانزا شناخته شده که متعلق به خانواده ارتوميكسوويريده است. ژنوم ویروس آنفلوانزا از RNA ی تک رشته ای تشکیل شده که در ویروس های آنفلوانزاي A و B به صورت 8 قطعه مجزاست در حاليكه ویروس های آنفلوانزاي C واجد هفت قطعه RNA ميباشند. قطعاتRNA ويروس، چندين پروتئين ساختاري از جمله هماگلوتينين (HA)، نورامينيداز (NA)، پروتئين ماتریکس (M)، نوكلئوپروتئين (NP) و همچنین پروتئين هاي غير ساختاري را رمزگذاري مي كنند. گلیکوپروتئینهاي هماگلوتينين و نورآمينيداز، مهمترین پروتئینهاي سطحی ویروس هستند كه به صورت زوائدي برروي پوشش ويروسي ديده مي شوند و بيشترين ميزان آنتي باديهاي خنثي كننده بر عليه آنها ساخته مي شود.[5]
ما در مطالعات فراوان در مورد ویروس آنفولانزا به این نتیجه رسیدیم که بسیاری از کارایی این ویروس به گلیکو پروتئینی بنام هماگلوتینین مربوط می شود ، و در این مقاله سعی کرده ایم تا نقش ایین گلوپروتئین را در این در عملکرد این ویروس بررسی کنیم.
در ابتدا نقش پروتئین ها را در ویروس بررسی کردیم سپس توضیحات مختصری درباره بیماری آنفولانزا و انواع آن ارائه دادیم و در نهایت وارد ساختار و نقش هماگلوتینین شدیم.
ویروس و پروتئین
ویروس یک انگل کوچک است که به خودی خود نمی تواند تولید مثل کند. با این وجود ، هنگامی که یک سلول حساس را آلوده کند ، ویروس می تواند اندامک های سلولی را هدایت کند تا ویروس های بیشتری تولید کند. بیشتر ویروسها دارای RNA یا DNA به عنوان ماده ژنتیکی خود هستند. اسید نوکلئیک ممکن است تک یا دو رشته باشد. کل ذره ویروس عفونی ، موسوم به ویریون ، از اسید نوکلئیک و یک پوسته بیرونی پروتئین تشکیل شده است . ساده ترین ویروس ها حاوی RNA یا DNA کافی هستند تا چهار پروتئین را رمزگذاری کنند. پیچیده ترین می تواند 100 – 200 پروتئین را کد کند.[6] (هماگلوتینین )
طبقه بندي ويروس آنفلوانزا
اصالتاً آنفولانزا به تب هايي که به صورت اپيدمي حاد به سرعت در انسان شيوع پيدا مي کند و توسط ارتوميکسوويروس ها ايجاد مي شوند گفته می شود. ويروس آنفلوانزا به خانواده ارتوميكسوويريده تعلق دارد. اين خانواده كه از ويژگي هاي اصلي آن دارا بودن ژنوم RNA تك رشته اي، قطعه قطعه با سنس منفي مي باشد، به 5 جنس تقسيم بندي مي گردد: آنفلوانزاي نوع A B C ايزاويروس یا آنمی سالمون عفونی و توگوتوويروس اساس طبقه بندي ويروس آنفلوانزا به 3 نوع B, A و C تفاوت هاي آنتي ژني بين دو پروتئين ماتريكس و نوكلئوپروتئين در واكنش هاي سرولوژي مي باشد. [3]
آنفلوانزاي A، اين ويروس مهم ترين عضو اين خانواده محسوب مي گردد زيراكه طيف وسيعي از ميزبان ها از جمله انسان، پرندگان و انواع گونه هاي پستانداران شامل خوك، اسب، سگ و غيره را آلوده مي كند. ويروس آنفلوانزاي A خود بر اساس واكنش هاي سرولوژي 2 پروتئين سطحي هماگلوتينين (HA) و نورامينيداز (NA) به ساب تايپ دسته بندي مي گردد. تاكنون 16 هماگلوتينين و 9 نورامينيداز شناسايي شده است.RNA ویروس عموما تک رشته ای و از8-7 قطعه تشکیل شده است که هر یک از قطعات خود حاوی 2-1 ژن میباشد به طور مثال ژنوم آنفولانزا نوع A دارای 8 قطعه و 11ژن می باشد[7] که 11 نوع پروتئین ویروس را با نام های زیر کد می کند:
HA NA NP M1 M2 NS1 NS2
PA PB1 PB1-F2 PB2
آنفلوانزاي B ، داراي ژنوم RNA 8 قطعه اي مي باشد و قادر است كه در جمعيت انساني اپيدمي ايجاد كند ولي تا به حال منجر به پاندمي نشده است. تنها ميزبان غير انساني شناخته شده براي اين ويروس خوك دريايي مي باشد. ويروس آنفلوانزاي B به جاي ساب تايپ به دودمان يا سويه دسته بندي مي گردد. در اين نوع ويروس آنفلوانزا دريفت آنتي ژني مشاهده شده است اما سرعت آن 3-2 برابر كمتر از تغييراتي است كه در آنفلوانزا A رخ مي دهد. تاكنون دودمان B/Victoria/2/87 در جمعيت انساني غالب بوده است ولي اخيرا با ظهور مجدد دودمان B/Yamagata/16/88 در سال 2001 و چرخش همزمان آن با دودمانB/Victoria/2/87 احتمال رخداد شيفت آنتي ژني بين اين ويروس ها قوت گرفته است.[5] هماگلوتینین
آنفلوانزاي C ، ژنوم RNA 7 قطعه اي دارد و به جاي HA و NA داراي يك گليكوپروتئين سطحي هماگلوتينين استراز فيوژن مي باشد. اين ويروس معمولا موجب بيماري خفيف در مجاري بالايي تنفسي مي گردد و البته ميتواند در نواحي تحتاني تنفسي نيز عفونت هايي مانند برونشيت و پنوموني ايجاد كند. شواهد اپيدميولوژي ويروس آنفلوانزاي C در مقايسه با 2 ويروس ديگر كمتر مي باشد زيرا با وجود آنكه بررسي هاي سرولوژيكي نشان داده است كه اين ويروس به طور وسيعي در جهان پخش شده است، اما شيوع و همه گيري بيماري ناشي از اين ويروس به ندرت مشاهده شده و جداسازي ويروس نيز بسيار كم اتفاق افتاده است. اساس دسته بندي اين ويروس به جاي ساب تايپ، سويه مي باشد. سويه ها از نظر ژنتيكي پايدار بوده و به مرور زمان تغييرات بسيار جزئي در آنها انباشته مي گردد. مطالعات اخير وقوع نوترتيبي بين سويه هاي اين ويروس را اثبات كرده است. ويروس آنفلوانزا C علاوه بر انسان قادر است خوك را نيز آلوده كند و حتي در جمعيت اين ميزبان از يك حيوان آلوده به حيوان ديگر نيز منتقل گردد.[8]
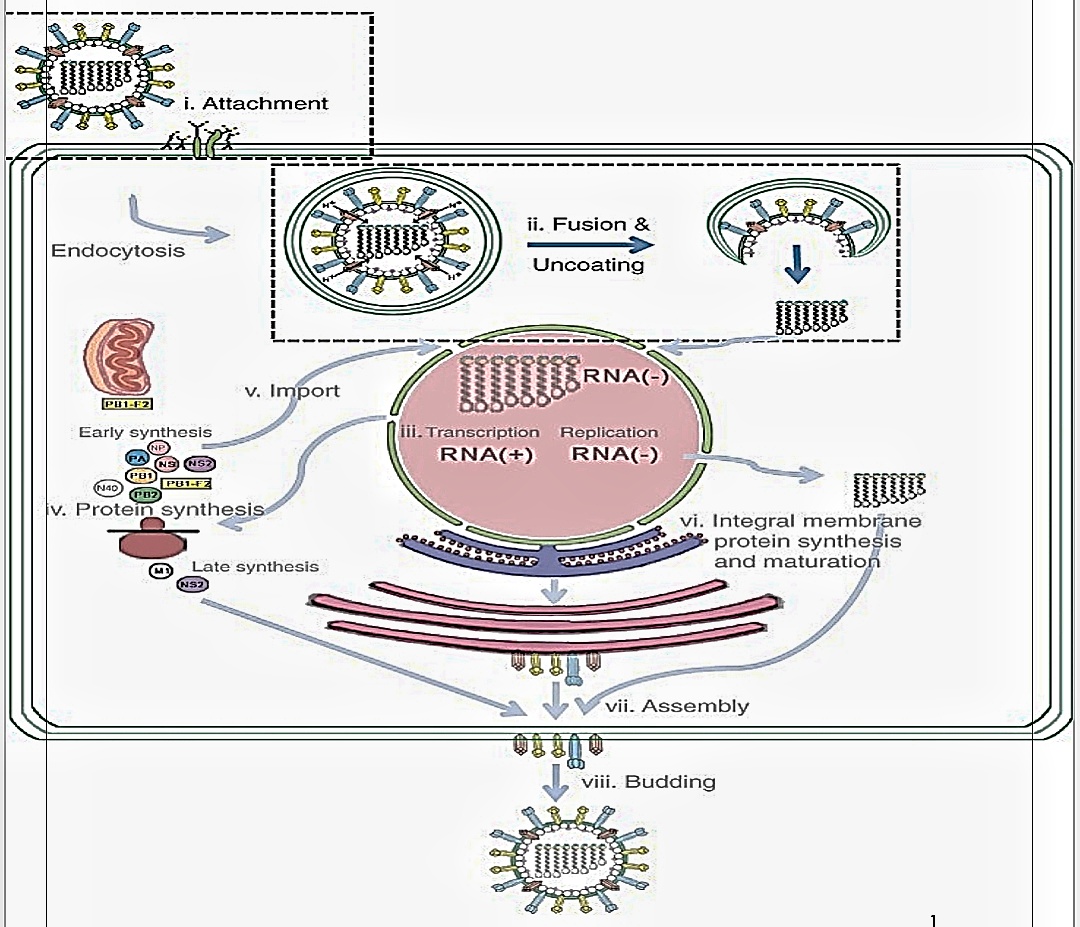
شکل ۱
چرخه تکثیر ویروس آنفلوانزا
(i) گلیکوپروتئین HA بر روی پوشش ویروسی با اتصال گیرنده های حاوی اسید سیالیک روی غشای سلول میزبان ، اجازه ورود ویروسی به سلول میزبان را می دهند.
(ب) پس از اتصال گیرنده و آندوسیتوز گیرنده با واسطه گیرنده ، pH پایین در وزیکول باعث ایجاد تغییر شکل در HA و در نتیجه تلفیق غشای ویروسی و وزیکول می شود. (iii) این ترکیب به ریبونوکلئوپروتئین های ویروسی (vRNPs) اجازه می دهد تا درون سیتوپلاسم آزاد شده و وارد هسته میزبان ، که در آن رونویسی و تکثیر ویروسی رخ می دهد ، شود.. (IV) RNA های رشته ای مثبت پس از رونویسی و پردازش با استفاده از اندامک های سلول میزبان در سیتوپلاسم برای تولید اجزای پروتئین ویروسی صادر و ترجمه می شوند. ( هماگلوتینین )
(v) پروتئین های ویروسی PB1 ، PB2 ، PA و NP که عملکرد vRNP ، NS2 (NEP) را در کنترل رونویسی ویروس و تنظیم و صادرات vRNP انجام می دهند و M1 مربوط به واردات هسته ای و صادرات vRNP را به داخل سلول وارد می کنند.
پروتئین NS1 یک پروتئین غیر ساختاری یک ویریون است که فعالیت مهاری در برابر پاسخ های ایمنی میزبان دارد. PB1-F2 به میتوکندری بومی سازی می شود و باعث افزایش آپوپتوز می شود. (vi) HA ، NA و M2 در شبکه آندوپلاسمی زبر سنتز شده و در جسم گلژی بلوغ می شوند.
(vii و viii) HA و NA گلیکوزیله شده بالغ ، M2 غیر گلیکوزیله شده ، NS2-M1-vRNPs و سایر شکل گیری های M1 و NS2 در زیر پوشش ویروس به غشای سلولی آپیکال منتقل می شوند ، جایی که آنها در یک ویروس زادگان جمع می شوند.
سرانجام از سطح سلول میزبان جوانه می زند. جعبه های شکسته مراحل چرخه زندگی آنفولانزا را نشان می دهد که در آن گلیکوپروتئین های سنبله HA عملکرد دارند و در این بررسی به تفصیل توضیح داده شده است.[9] هماگلوتینین
نامگذاري ويروس
نامگذاري ويروس آنفلوانزا به گونه اي انجام مي شود كه در عين سادگي، از يك قانون كلي براي تمامي انواع اين ويروس تبعيت كند و از طرفي ديگر داراي تمامي اطلاعات مفيد و لازم باشد. ساختار نامگذاري شامل:
1- تايپ آنتي ژني (A, B or C)
2- حيوان ميزباني كه ويروس از آن جدا شده است (البته در مورد ويروس هاي جدا شده از انسان معمولا از آوردن نام ميزبان خودداري مي گردد).[10]
3- ناحيه جغرافيايي كه ويروس از آن جدا شده است، مانند شهر، ايالت، استان و حتي كشور
4- شماره شناسايي خاص ويروس جدا شده و يا شماره انحصاري يك آزمايشگاه
5- سال جداسازي ويروس
6- ساب تايپ هاي HA و NA كه معمولا در پرانتز نمايش داده مي شود. براي مثال ويروسي كه از بوقلمون در سال 1999 از ميسوري امريكا جدا شده است را به صورت زير نشان مي دهند:
A/turkey/Missouri/24093/1999 (H1N2) هماگلوتینین
تغييرات ژنومي ويروس آنفلوانزا
تغييرات ژنومي ويروس آنفلوانزا به 2 شكل دريفت آنتي ژني و شيفت آنتي ژني رخ مي دهد. يكي از دلايل اين جهش هاي سريع عملكرد نيمه دقيق آنزيم رپليكاز RNA (پليمراز وابسته بهRNA )و همين طور عدم توانايي آنزيم در تصحيح اشتباهاتش مي باشد.[1] هماگلوتینین آنتي ژني زماني رخ مي دهد كه ژن هاي كد كننده HA و يا NA در حين تكثير ويروس متحمل جهش گردند. اين امر گاهي موجب مي شود كه ويروس جديد بتواند از سيستم ايمني گريخته و منجر به بيماري و اپيدمي در جمعيت ميزبان مربوطه گردد.
شيفت آنتي ژني كمتر مرسوم است و زماني اتفاق مي افتد كه دو ويروس مجزا ( مي توانند از دو گونه ميزباني متفاوت باشند)، به طور همزمان يك ميزبان حد واسط مانند خوك را آلوده كنند. با جابه جايي قطعات ويروس با يكديگر، ويروس جديدي پديدار مي گردد كه منشاء قطعات ژنومي آن از دو ويروس اوليه مي باشد. [11] بيماري زايي ويروس جديد غير قابل پيش بيني است زيراكه ممكن است ويروس جديد فاقد فاكتورهاي بيماري زاي ضروري باشد و در نتيجه يك ويروس تخفيف حدت يافته و يا صراحتا يك ويروس غير زنده ايجاد گردد. از طرفي ديگر ممكن است كه ويروس جديد كاملا بيماري زا بوده و همين طور يك HA جديد كه معمولا منشاء آن از يك حيوان و يا ميزبان ديگر است، در تركيب اين ويروس وجود داشته باشد.
نتيجه فرآيند اخير، ويروسي است كه به طور بالقوه امكان ايجاد پاندمي در جمعيت انساني را دارد، زيرا كه هم توانايي بيماري زايي بالايي دارد و هم اينكه جمعيت ميزبان نسبت به آنتي ژن سطحي HA جديد عرضه شده هيچگونه سابقه ايمني ندارد. به محض ايجاد يك سويه پاندمي، ويرولانس اين ويروس دستخوش تغيير شده و به مرور به ميزبان عادت مي كند.[12] هماگلوتینین
ویژگی های ساختاری هماگلوتینین
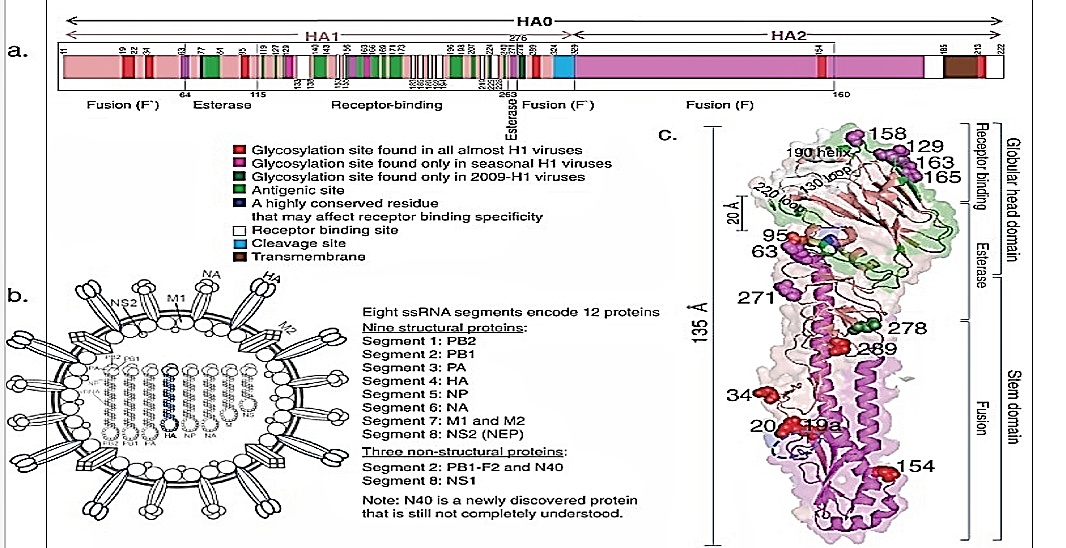
A) تركیب زنجیره پلی پپتیدی باز از HA0 ویروس H1 ، كه از HA1 و HA2 حاوی 3 منطقه مختلف تشکیل شده است: (i) همجوشی (شامل مناطق N- و C- انتهایی HA1 (زیر دامنه ′F) و HA2 (زیر دامنه F) ، که در حوزه ساقه قرار دارد (c) ، ساختار اصلی مسئول اندامک فیوژن غشایی) ، (ii) استراز (متشکل از دو زیر دامنه بین′F و گیرنده مناطق اتصال ، که در وسط HA باز (c) قرار دارند) و (iii) اتصال گیرنده (c) مناطقی که نشان داده شده است. B) شکل شماتیک از ذره ویروس آنفلوانزا: هماگلوتینین ها بر روی سطح ویروسی به عنوانفرم های اصلاح شده کد شده از یک قطعه ژن یافت می شوند.[13]
C) یک نمودار کارتونی از α- مارپیچ ها و β- ورق های HA0 در یک مونومرفشرده به طول حدود 135 Å است. Salmon، HA1 ؛ Warmpink، HA2. محل اتصال گیرنده (سفید) یک پاکت ساخته شده توسط 130 حلقه ، 190 مارپیچ و 220 حلقه است که در قسمت بالای دامنه کره قرار دارد. اسید آمینه در موقعیت 77 (آبی تیره) در دامنه استراز در زیر محل اتصال گیرنده در حدود 20 Å از گونه های خاص است ، D در HA های پرندگان و E در اکثر HA های انسانی (شکل 3) ، مکانهای آنتی ژنی مکانهای اتصال گیرنده (سفید و آبی تیره) را در دامنه کروی احاطه می کنند. محل های گلیکوزیلاسیون (کره) را می توان در سراسر مولکول HA ویروس های H1 فصلی (مژگان و کره های قرمز) یافت. هر دو ویروس همه گیر 1918-H1 و 2009-H1 سایت های گلیکوزیلاسیون را فقط در زیر محل اتصال گیرنده (کره قرمز) حمل می کنند ، و 2009-H1 HA دارای یک محل گلیکوزیلاسیون اضافی در موقعیت 278 (کره سبز) است.[9]
ساختار گلیکوپروتئین هماگلوتینین
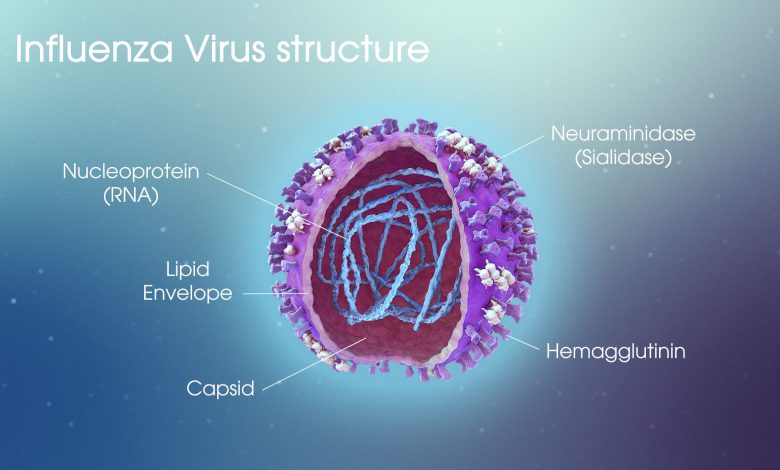
ویروس آنفلوانزا A که اندازه کروی قطری در حدود 100 نانومتر دارد. همانطور که در شکل 2 قسمت b نشان داده شده است ، از یک لایه لیپید تشکیل شده است که از غشای پلاسمایی میزبان مشتق شده است و مجتمع ریبونوکلئوپروتئین (RNP) را شامل می شود که از هشت بخش RNA تک رشته ای منفی (ssRNA) با حس منفی تشکیل شده است. ، PB2 و PA) و نوکلئوپروتئین (NP). هشت بخش ssRNA 12 پروتئین ویروسی را رمزگذاری می کند. پروتئین های مرتبط با پاکت ، هماگلوتینین (HA) و نورآمینیداز (NA) به عنوان سنبله در لایه لیپید قرار می گیرند. پروتئین ماتریس M1 در صادرات هسته ای نقش دارد و در زیر لایه لیپید وجود دارد. کانال یونی پروتون M2 در لایه لیپید تعبیه شده و در نگهداری pH نقش دارد. پروتئین اساسی پلیمراز 1 (PB1) و 2 (PB2) و پروتئین اسید پلیمراز (PA) یک پلیمراز RNA وابسته به RET تشکیل شده است. پروتئین پایه 1 پلیمراز 1 قاب 2 (PB1-F2) ، پروتئین غیر ساختاری کد گذاری شده از دوم از سه قاب خواندن از بخش RNA PB1 RNA مسئول بیماری زایی است. پلی پپتید کوتاه شده N-terminal (N40) پروتئینی است که اخیراً یافت شده است که در ابتدا در AUG5 کدون PB1 40 در mRNA ترجمه می شود: به نظر می رسد با مجموعه پلیمراز تعامل داشته باشد ، و از بین رفتن بیان آن می تواند منجر به اختلال در تکثیر نوکلئوپروتئین ها شود. ) مورد نیاز برای تکثیر ویروسی با مولکولهای vRNA همراه است. پروتئین غیر ساختاری NS1 در هسته سلولهای آلوده ترویج تکثیر ویروس و حدت موثر است.[13] پروتئین غیر ساختاری 2 (NS2) کدگذاری شده از همان بخش ژنتیکی همانند NS1 اما با ترکیبی جایگزین ، همچنین به عنوان پروتئین صادرات هسته ای (NEP) نامیده می شود زیرا حاوی یک سیگنال صادراتی هسته ای غنی از لوسین است که به پروتئین M1 وصل شده است. ویروس آنفلوانزا HA توسط بخش RNA کدگذاری می شود. بطور کلی ترجمه شده در غشای خلفی آندوپلاسمی شبکه (RER) منتقل می شود (شکل (1 ، مرحله vi)) و یک پروتئین پیش ساز ، یک همو اصلاح کننده غیر کووالانس (بنام HA0). پپتید سیگنال (17 اسید آمینه) شکاف و گلیکوزیلاسیون مرتبط با N در طی فرآیند ترجمه ترجمه رخ می دهد.
تعداد و پیچیدگی N-glycans برای شکل گلیکوزیله شده با 549 اسید آمینه باقی مانده (شکل (شکل 2a2a و and3). HA0 از طریق مجتمع Golgi به غشای پلاسمایی منتقل شده و توسط پروتئازهای سلولی بریده می شود) (شکل 1، مراحل vii و viii) برای به دست آوردن HA1 (327 اسید آمینه) و HA2 (222 اسید آمینه) ، که هنوز توسط پیوند دی سولفید مرتبط هستند ؛ بیشتر ویروس های آنفلوانزا حاوی یک اسید آمینه اساسی اساسی (آرژنین ، بندرت لیزین) هستند.
در محل برش گلیکوپروتئین HA در داخل ویروس آنفلوانزا یک پروتئین غشایی داخلی(گلیکوپروتئین transmembrane نوع I) است که دارای یک شکل استوانه ای با ابعاد تقریبی 135 و 35-70 Å (شعاع) تشکیل سنبله هایی است که به صورت بیرونی طراحی می شود. هر مونومر از مولکول HA از یک دامنه سر گلوبولار در یک دامنه ساقه (شکل 2c). دامنه ی کره ی زمین فقط بخشی از HA1 را شامل می شود، تمام شماره اسیدهای آمینه HA در طول این بررسی بر اساس H3 HA است.
دامنه کروی از بقایای HA1 116–261 تاشونده به یک نقوش ژله ای از 8 ورقه بتا ضد قطر رشته ای و درون یک جیب کم عمق در نوک دیستال که به عنوان یک سایت اتصال گیرنده احاطه شده توسط سایت های آنتی ژنیک تشکیل شده است. قسمت های باقیمانده HA1 عمدتا با ورق های بتنی به ساقه منتهی می شوند.
HA2 ، که بخش عمده ای از دامنه ساقه است ، به طور عمده در یک ساختار سیم پیچ مارپیچ مارپیچ قرار دارد که توسط آن مارپیچ 80 طول طول ستون فقرات ساقه را تشکیل می دهد. HA2 حاوی پپتید آبگریزی مورد نیاز برای همجوشی غشایی است که از رابط کاملاً دور (در حدود 35 Å) از پایین مولکول قرار دارد. بخشی از HA2 یک زنجیره مارپیچ طولانی با 28 اسید آمینه است که در غشای لنگر انداخته شده و یک الیگوساکاریدهای مرتبط با دم سیتوزولی 10 باقیمانده ، که بر عملکردهای HA تأثیر می گذارند ، هم در نواحی گلوبولار و هم ساقه یافت می شوند. به نظر می رسد که سایت های گلیکوزیلاسیون تغییرات زیادی در ناحیه سر گلوبولار HA1 دارند اما در منطقه ساقه HA1 و HA2 بیشتر حفظ می شوند.[14]
گلیکوپروتئین هماگلوتینین
پروتئینی در سطح آنفولانزا است که نقش مهمی در توانایی ویروس برای آلوده کردن سلول ها دارد و هنگامی که ویروس به سلول میزبان متصل می شود ، دچار تغییر شکل سازنده می شود. هماگلوتینن (HA) پروتئینی است که در لایه بیرونی ویروس، پوشش ویروس واقع شده است. این یک قند غشای سلولی ما ، اسید سیالیک را تشخیص می دهد ، که وظیفه آن شناسایی ویروس و اتصال آن به سلولهای دستگاه تنفسی ماست.[15]
این نام از توانایی آن در تشخیص و اتصال به سلول ها و پیوند گلبول های قرمز، یکی از اولین آزمایشاتی است که برای تشخیص ویروس ایجاد شده است. تعداد آن براساس تغییر اسیدهای آمینه داده می شود. بیش از 15 نوع HA شناخته شده است و H1 ، H2 و H3 رایج ترین ویروس هایی است که به انسان آلوده می شوند.[3]
همجوشی غشایی با واسطه هماگلوتینین
در مرحله اولیه چرخه زندگی آنفولانزا ، ویروس باید غشای ویروسی را با غشای میزبان ذوب کند تا مواد ژنتیکی ویروسی را برای تکثیر آن در سلول های میزبان رها کند (شکل 1). HA های باز شده (HA0) قادر به ادغام غشاها نیستند ، بنابراین باید ویروس های آنفلوانزا HA0 به دو زیر واحد ، یک سر HA1 و یک ساقه HA2 ، توسط یک پروتئاز میزبان ، که در آن تولید پپتید N- ترمینال فیوژن HA2 انجام می شود ، تقسیم شود. 20-25 مانده باقیمانده HA2) با pH خنثی در داخل مولکول دفن می شود (شکل 7a و and77b) پروتئاز مانند تریپسین مانند میزبان ، مانند پلاسمین یا تریپتاز ، که فقط در نقاط خاصی از بدن قرار دارد ، بطور کلی در سطوح مخاطی دستگاه های تنفسی و دستگاه گوارش. این پروتئازهای میزبان بنابراین تعیین کننده سایتهای تکثیر ویروسی هستند. در مقابل ، HA0 با یک سری اسیدهای آمینه اساسی Arg-X-Arg / Lys-Arg یا مشتقات آن ، که در آن X یک اسید آمینه غیر پایه در محل برش پروتئولیتیک است ، که در برخی از گونه های مرغی (معمول تا بسیار زیاد) وجود دارد.[16] ویروس های بیماری زا H5 و H7 ناشی از جهش زاینده های کم بیماری زای H5 و H7 در طیور) ، در محفظه ترانس گلگی توسط پروتئازهای همه جا که موتیف multibasic مانند فورین (یک آندوپروتازاز subtilisin مانند) و پروتئین پروتئین داخل سلولی جدا می شوند. 6 (PC6) ، در طیف گسترده ای از سلول های میزبان مختلف وجود دارد. از این رو ، ویروس های آنفلوانزا بسیار بیماری زا باعث ایجاد عفونت کشنده سیستمیک با میزان مرگ و میر بالا در طیور تا 100٪ می شوند.[17] عبور ویروس های آنفلوانزا در هر دو سلول کشت و یا سلول های جنین مرغ در حضور پروتئاز غیر تریپسین مانند با خاصیت محل جداشدگی خنثی ، کیموتریپسین ، الاستاز یا ترمولیزین ، منجر به جایگزینی اسید آمینه اساسی (Arg) در شکاف HA0 شد. سایت توسط یک اسید آمینه خنثی ، مانند ایل ، Thr یا Met ، بسته به ویژگی بستر آن پروتئینازها. چنین ویروس های جهش یافته حاوی HA0s بودند که در برابر فعال سازی تریپسین مقاوم بودند اما می توانند توسط پروتئاز مربوطه در انواع مختلف سلول فعالشوند و برای مرغ ها بیماری زا بودند.[18]
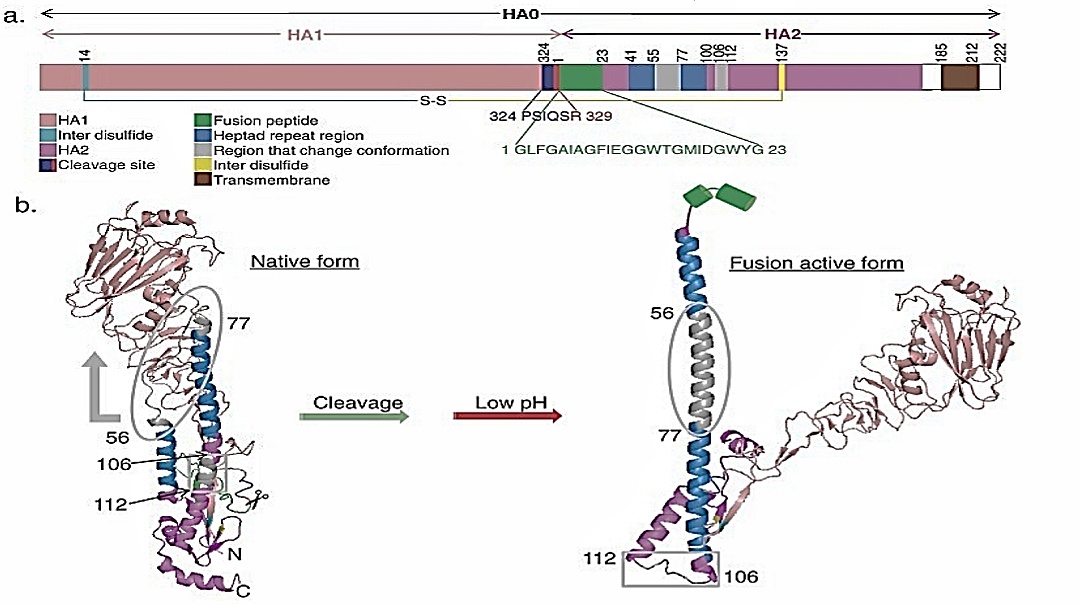
تغییرات ساختار HA در pH فیوژن غشایی
A) ساختار اولیه پروتئین HA0 نشان دهنده یک پل دی سولفید (SS) متصل (پیوند سیان و زرد) بین HA1 (ماهی قزل آلا) و HA2 (سرخ) ، محل برش (آبی تیره و قرمز) ، پپتید فیوژن (سبز) ، تکرار هپاد مناطق (دریایی) ، مناطق تغییر شکل سازگار هنگامی که HA در pH اسیدی (خاکستری) و دامنه transmembrane (شکلاتی) است.[19]
B) ساختار سوم یک مونومر HA بین R329 (قرمز) و 1G (سبز) به یک فرم HA1-S-S-HA2 با همجوشی شکافته می شود و در یک محیط اسیدی که منجر به تغییر ساختار می شود ، شکاف می یابد. HA2 در غیاب HA1 به فرم فعال فیوژن بازگردد. پپتید فیوژن (سبز) بیرون می آید و سپس به سمت آن حرکت می کند و در غشای اندوزومی میزبان وارد می شود و منجر به همجوشی غشای می شود. رنگهای نشان داده شده در A با رنگهایB مطابقت دارند.[20]
پس از اتصال HA1 به گیرنده های اسید سیالیک یا در پیوندهای α2-3 یا α2-6 ، ویروس (آندوسیتوز) به درون یک اندوزوم گرفته می شود. همانطور که در شکل 7b نشان داده شده است ، در pH پایین در درون آندوزوم ، شکافیده شده HA متحمل یک تغییر کنفورماسیونی شدید می شود ، که در آن دامنه سر HA1 مخدوش می شود و از دامنه همجوشی HA2 جدا می شود ، به جز یک پل دی سولفید که بین بازمانده های 14 و 137 مرتبط است ، و دامنه HA2 تحت دو بازآرایی سازه اصلی قرار دارد که (من) یک انتقال حلقه به مارپیچ در قسمت N ترمینال HA2 در موقعیتهای اسید آمینه 55-76 و در نتیجه فرمت سیم پیچ سیم پیچ و (ب) مارپیچ- انتقال به حلقه اسیدهای آمینه در موقعیت های 106-1121 در سیم پیچ مرکزی سیمان HA2 و در نتیجه وارونگی همه موجودات ساختاری در قسمت C ترمینال HA2 توسط 180 درجه. این تنظیم مجدد منجر به تشکیل یک واسطه طولانی می شود. پپتید فیوژن هیدروفوبیک N ترمینال از یک جیب آبگریز در سنبله در نزدیکی غشای ویروسی به غشای اندوزومال خارج می شود ، در حالی که لنگر transmembrane C- ترمینال HA2 در غشای ویروسی باقی مانده است. سطح متوسط گسترش یافته با فروپاشی لنگرهای غشایی N- و C با هم به هم می خورد. این فروپاشی باعث ایجاد hemifusion (همجوشی جزوات بیرونی دو غشاء) و تشکیل منافذ فیوژن (شکل 8)[21] (هماگلوتینین )
پیامدهای همجوشی غشایی توسط آنفلوانزا HA
A) در حالت پیش از فیوژن ، پپتیدهای فیوژن (سبز) در N- پایانه HA2 در فضای داخلی سازه توقیف می شوند (کد PDB 1ruz). ب) پس از جدا شدن پروتئولیتیک در مانده آرژینین HA2 329 ، محیط اسیدی باعث ایجاد تغییرات ساختاری و در نتیجه حذف HA1 ها و قرار گرفتن در معرض پپتیدهای فیوژن (کد PDB 1htm) می شود. از آنجا که پپتیدهای فیوژن آبگریز هستند ، آنها با تاشو در یک ساختار بومرنگ شکل برای تعامل های محکم با غشاء ، با غشای دو لایه (حالت متوسط گسترش یافته) تداخل می کنند. در صفحه ، لمس ساختار بومرنگ مورد نیاز برای همجوشی غشاء با استفاده از باقیمانده تریپتوفان (W) در موقعیت HA2 14 (قرمز) تثبیت می شود. ج) تنظیم مجدد ساختار بیشتر در HA2 منجر به انتساب پاکت ویروسی و غشای اندوزومال (فروپاشی واسطه طولانی) می شود.[22, 23] وقتی این دو لایه با هم تماس پیدا کنند ، آنها باعث ایجاد خونریزی می شوند ، د) ایجاد دو لایه به درون منافذ فیوژن (حالت تشکیل منافذ فیوژن). پس از تنظیم مجدد HA2 تا زمانی که کاملاً متقارن شود ، منافذ قابل تجدید نظر نیست (حالت پس از فیوژن).[24]
نتیجه گیری
پیشرفت های زیادی در مطالعات مربوط به HA ویروس های آنفلوانزا A حاصل شده است ، و نتایج پایه ای برای درک نقش HA در تغییرات آنتی ژنی ، دامنه میزبان و همجوشی غشایی در ورود ویروسی فراهم کرده است. با این حال ، هنوز به برخی از سؤالات کلیدی پاسخ داده نشده است.[25]
به عنوان مثال ، دقیقاً چگونگی ایجاد یک فشار همه گیر جدید ناشناخته است. مشخص نیست که چرا ویروس H1N1 با منشاء خوکی در سال 2009 همه گیر شد (توزیع جغرافیایی در سراسر جهان در جمعیت های انسانی) ، در حالی که سایر ویروس های خوکی ، از جمله ویروس های والدین شخصی وی (ویروس های خوکی آمریکای شمالی و اوراسیا) حتی با وجود ویروس های خوکی همه گیر نشدند. شناخته شده است که گاهی به طور مستقیم از خوک به انسان منتقل می شود. [26]
عوامل مختلفی مانند HA ، PB2 و NA ممکن است در تکامل یک ویروس ویروس آنفلوانزای همه گیر نقش داشته باشد. تحقیقات اندکی انجام شده است تا احتمال ویروس آنفلوانزا غیر انسانی را برای شناسایی گلیکان های طولانی مدت α2-6 سیلیلیزه شده برای انتقال موثر در جمعیت های انسانی بدست آورد تا همه گیر شود. به تازگی ، جدا شده ویروس آنفلوانزای خوکی آمریکای شمالی نشان داده شده است که به گیرنده های طولانی مرتبط با α2-6 متصل به پروفایل های اتصال گیرنده ایزوله های H1N1 اولیه همه گیر انسانی 2009 و جدایه های فصلی H1N1 قبلی متصل می شود. همچنین ، تجزیه و تحلیل N- گلیکان سلولهای کشت شده سلولهایاپیتلیال تنفسی خوکی اولیه (SRECs) وجود گیرنده های طولانی α2-6 در SRECs را نشان داد ، نه تنها در سلول های اپیتلیال برونش انسان.
بنابراین ، تجزیه و تحلیل بیشتر توالی glycans بیان شده بر روی بافت های میزبان حیوانات و آزمایش های بیشتر روی آرایه های گلیکان تحت شرایط طبیعی نزدیکتر با همبستگی با تجزیه و تحلیل ساختاری اتصال ویروس آنفلوانزا HA یا آزمایش های اتصال دهنده گیرنده داخل بدن ، بدون شک منجر به درک گلیکان خواهد شد ویژگی های اتصال دهنده ویروس آنفلوانزا HA و تغییر در آنفلوانزا که منجر به تغییر در دامنه میزبان آنفولانزا می شود.
درسهایی از دو بیماری همه گیر گذشته در سال 1957 و 1968 که ناشی از انتقال مجدد بین ویروسهای آنفلوانزای مرغی پاتوژن انسانی و پائوژن هستند ، باید برای تقویت نظارت و پاسخ به ظهور سویه های reassortant جدید ، به ویژه بین رمان H1N1 جدید که به سرعت در بین انسان ها پخش می شود ، یاد بگیرند. به عنوان غالبيت آنفلوانزا در اكثر مناطق دنيا امروزه و ويروس آنفلوانزاي H5N1 آنفلوآنزاي مرغي بسيار بيماريزا در حال حاضر باعث آلودگي پوراديك انسان با ميزان مرگ و مير بالا مي شود. مکانیسم فیوژن مدلی است که باید به صورت تجربی تأیید شود.[25]
مطالعات بعدی ، مانند توالی توالی همراه با بیوانفورماتیک ، تجزیه و تحلیل های تجربی و استفاده از ترکیبات خاص با اقدامات شناخته شده ، باید از مکانیسم های تغییر آنتی ژن ویروس های آنفلوانزا ، ظهور سویه های همه گیر ، اتصال گیرنده و فیوژن پرده برداشته و منجر به پیشرفت رمان شود واکسن ها و داروها برای پیشگیری ، کنترل و درمان آنفولانزا.
اگرچه چندین ترکیب برای مهار توابع HA و عفونت ویروس گزارش شده است ، به عنوان مثال ، گلیکوپلیمرهای حاوی تکرارهای N-acetyllactosamine و مهار کننده های کربوکسامید N- (1-تیا-4-آزاسپیرو [4.5] دکان-4-ییل) مهار و فعالیتهای مهاری فیوژن غشایی با واسطه HA ، به ترتیب ، هیچ مهار کننده بالینی HA در حال حاضر در دسترس نیست.
این امکان وجود دارد که در آینده نزدیک برای داروهای ضد آنفلوانزا مهارکننده های ضد HA بهبود یافته و جدید ایجاد شوند و ممکن است به همراه داروهای ضد آنفولانزا در حال حاضر ، مانند کربوکسیلات اوسلتامیویر (تامیفلو ؛ مهار کننده NA) و زانامیویر (Relenza؛ NA) استفاده شوند. بازدارنده) و / یا با سایر داروهای ضد آنفلوانزا به تازگی ایجاد شده ، مانند T-705 (فاویپیراویر ، مهار کننده RNA پلیمراز RNA ویروس) ، پرامیویر (مهار کننده طولانی مدت NA) و اکتانوات لانانامیویر (مهار کننده طولانی مدت NA) ، به منظور افزایش کارآیی آنها و / یا کاهش انتشار سریع ویروسهای آنفولانزا مقاوم به دارو به عنوان نتیجه تکرار مستعد خطا ویروسهای آنفلوانزا.[27]
منابع
- Goldsmith, C., Influenza: The Next Pandemic? 2007: Twenty-First Century Books.
- Bateman, A.C., et al., Glycan Analysis and Influenza A Virus Infection of Primary Swine Respiratory Epithelial Cells THE IMPORTANCE OF NeuAcα2–6 GLYCANS. Journal of Biological Chemistry, 2010. 285(44): p. 34016-34026.
- Munster, V.J., et al., Spatial, temporal, and species variation in prevalence of influenza A viruses in wild migratory birds. PLoS pathogens, 2007. 3(5): p. e61.
- Webster, R.G. and E.J. Walker, Influenza: The world is teetering on the edge of a pandemic that could kill a large fraction of the human population. American Scientist, 2003. 91(2): p. 122-129.
- Johnson, N.P. and J. Mueller, Updating the accounts: global mortality of the 1918-1920″ Spanish” influenza pandemic. Bulletin of the History of Medicine, 2002. 76(1): p. 105-115.
- Skehel, J.J. and D.C. Wiley, Receptor binding and membrane fusion in virus entry: the influenza hemagglutinin. Annual review of biochemistry, 2000. 69(1): p. 531-569.
- Wise, H.M., et al., A complicated message: Identification of a novel PB1-related protein translated from influenza A virus segment 2 mRNA. Journal of virology, 2009. 83(16): p. 8021-8031.
- Hale, B.G., et al., The multifunctional NS1 protein of influenza A viruses. Journal of general virology, 2008.
- Sriwilaijaroen, N. and Y. Suzuki, Molecular basis of the structure and function of H1 hemagglutinin of influenza virus. Proceedings of the Japan Academy, Series B, 2012. 88(6): p. 226-249.
- Nayak, D.P., E.K.-W. Hui, and S. Barman, Assembly and budding of influenza virus. Virus research, 2004. 106(2): p. 147-165.
- Böttcher-Friebertshäuser, E., et al., The hemagglutinin: a determinant of pathogenicity, in Influenza Pathogenesis and Control-Volume I. 2014, Springer. p. 3-34.
- Tehran University Medical Journal, 1978. 35(7): p. 120-126.
- Wang, C.-C., et al., Glycans on influenza hemagglutinin affect receptor binding and immune response. Proceedings of the National Academy of Sciences, 2009. 106(43): p. 18137-18142.
- Medina, R.A., et al., Pandemic 2009 H1N1 vaccine protects against 1918 Spanish influenza virus. Nature communications, 2010. 1: p. 28.
- Shinde, V., et al., Triple-reassortant swine influenza A (H1) in humans in the United States, 2005–2009. New England Journal of Medicine, 2009. 360(25): p. 2616-2625.
- Sugaya, N. and Y. Ohashi, Long-acting neuraminidase inhibitor laninamivir octanoate (CS-8958) versus oseltamivir as treatment for children with influenza virus infection. Antimicrobial agents and chemotherapy, 2010. 54(6): p. 2575-2582.
- Liu, J., et al., Structures of receptor complexes formed by hemagglutinins from the Asian Influenza pandemic of 1957. Proceedings of the National Academy of Sciences, 2009. 106(40): p. 17175-17180.
- Suzuki, Y., M. Matsunaga, and M. Matsumoto, N-Acetylneuraminyllactosylceramide, GM3-NeuAc, a new influenza A virus receptor which mediates the adsorption-fusion process of viral infection. Binding specificity of influenza virus A/Aichi/2/68 (H3N2) to membrane-associated GM3 with different molecular species of sialic acid. Journal of Biological Chemistry, 1985. 260(3): p. 1362-1365.
- Bullough, P.A., et al., Structure of influenza haemagglutinin at the pH of membrane fusion. Nature, 1994. 371(6492): p. 37.
- Baum, L. and J. Paulson, Sialyloligosaccharides of the respiratory epithelium in the selection of human influenza virus receptor specificity. Acta histochemica. Supplementband, 1990. 40: p. 35-38.
- Ito, T., et al., Recognition of N-glycolylneuraminic acid linked to galactose by the α2, 3 linkage is associated with intestinal replication of influenza A virus in ducks. Journal of virology, 2000. 74(19): p. 9300-9305.
- Chandrasekaran, A., et al., Glycan topology determines human adaptation of avian H5N1 virus hemagglutinin. Nature biotechnology, 2008. 26(1): p. 107.
- Bradley, K.C., et al., Comparison of the receptor binding properties of contemporary swine isolates and early human pandemic H1N1 isolates (Novel 2009 H1N1). Virology, 2011. 413(2): p. 169-182.
- Takemae, N., et al., Alterations in receptor-binding properties of swine influenza viruses of the H1 subtype after isolation in embryonated chicken eggs. Journal of General Virology, 2010. 91(4): p. 938-948.
- Matrosovich, M., et al., Avian influenza A viruses differ from human viruses by recognition of sialyloligosaccharides and gangliosides and by a higher conservation of the HA receptor-binding site. Virology, 1997. 233(1): p. 224-234.
- Reid, A.H., et al., Origin and evolution of the 1918 “Spanish” influenza virus hemagglutinin gene. Proceedings of the National Academy of Sciences, 1999. 96(4): p. 1651-1656.
- Chen, C.-J., et al., Differential localization and function of PB1-F2 derived from different strains of influenza A virus. Journal of virology, 2010. 84(19): p. 10051-10062.