فهرست مطالب
سجاد بابائی ( شیوع بیماری های عفونی و آینده پیش رو )
کارشناس و کارشناس ارشد میکروبیولوژی
دانشجوی دکتری نانوبیوتکنولوژی
1-نگاهی به چالش های پیش رو
بنیاد چالشهای جهانی (GCF) در سال 2016 فهرستی از خطرات فاجعهآمیز که جوامع بشری را در حال حاضر تهدید به نابودی میکنند، منتشر کرده و آنها را بررسی نمود. این خطرات پتانسیل نابود کردن نزدیک به یکدهم جمعیت دنیا را در حداقل حالت خود دارند. در این گزارش عمدهترین خطرات جهانی بهاینترتیب معرفی شدند:
1) تغییر اقلیم و گرمایش جهانی
2) جنگ هستهای
3) پاندمیهای طبیعی
4) خطرات خارجی (مخاطرات فضایی)
5) خطر تکنولوژیهای جدید (بیوتروریسم، هوش مصنوعی و مهندسی کره زمین)
6) دیگر مخاطرات و خطرهای ناشناخته تا به امروز
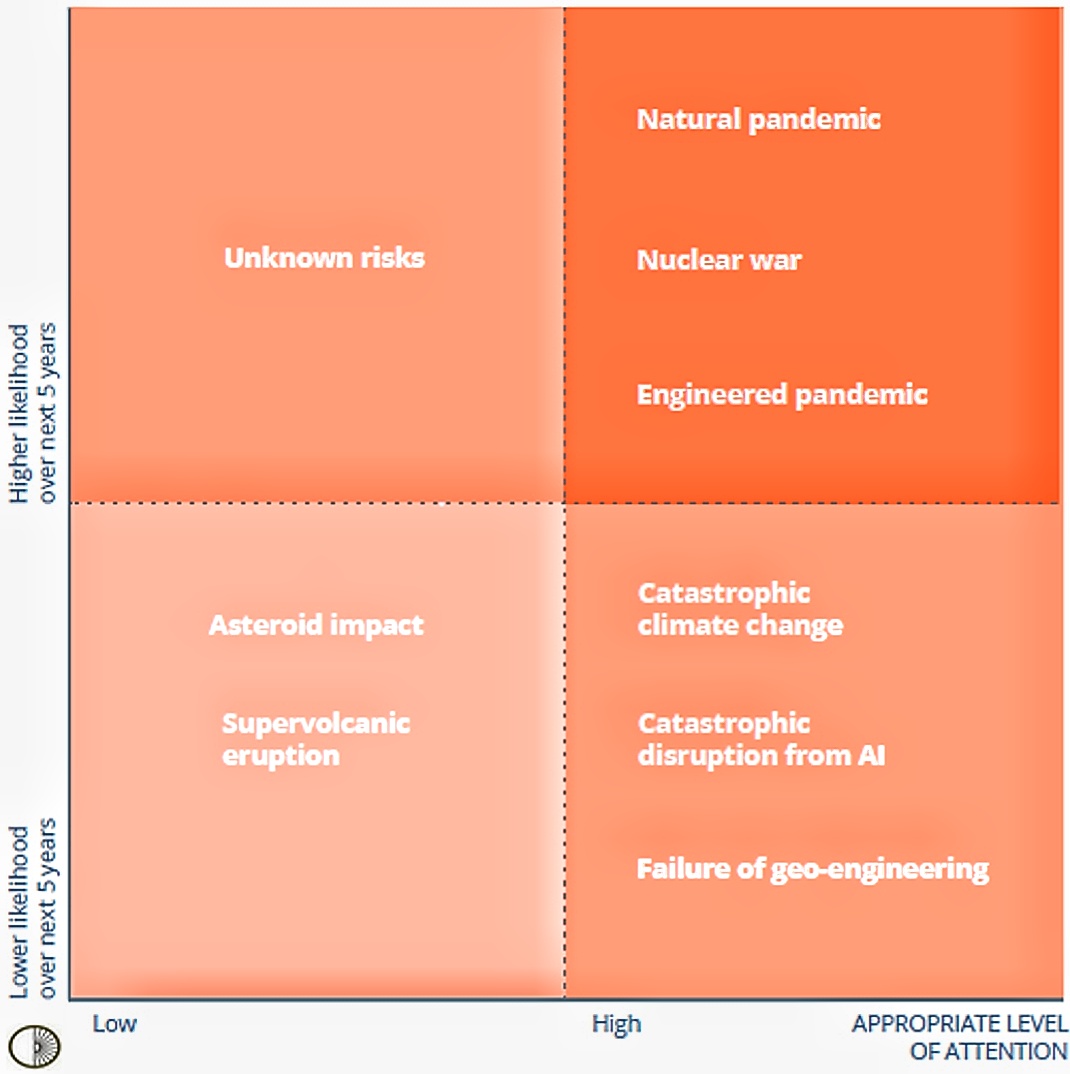
در میان موارد تعیینشده بهعنوان عوامل تهدیدکننده جوامع بشری میتوان پاندمی طبیعی و بیوتروریسم را دید که اهمیت شیوع بیماریهای عفونی را نشان میدهد و الزام باور به خطری که وجود دارد. تصویر (1) ارزیابی این مخاطرات را نشان میدهد که میتوان در آن متوجه اهمیت تهدید از جانب پاندمیهای طبیعی و پاندمیهای مهندسیشده (بیوتروریسم) شد.
تصویر -1 : ارزیابی بنیاد چالشهای جهانی (GCF) از خطراتی با پتانسیل تهدید سلامت جوامع انسانی(پاندمی طبیعی، جنگ هستهای و پاندمی مهندسیشده در بالاترین شانس رخ داد بوده و بیشترین توجه را میطلبند).
[The Global Challenges Foundation.(2016).Global Catastrophic Risks. University Of Oxford]
طاعون، آبله، آنفلوانزا و دیگر پاندمی ها تابهحال میلیونها نفر از مردم را به کام مرگ فرستادهاند و ثابت کردهاند که شیوع بیماری عفونی و ایجاد پاندمی یک خطر جدی است. امروزه این خطر بیشتر از جانب بیماری عفونی آنفلوانزای پرندگان احساس میشود و این در حالی است که فعالیتها و نحوه زندگی انسانها و حتی برخی از عوامل تهدیدکننده دیگر جا گرفته در لیست، همانند تغییر اقلیم و گرمایش جهانی، جنگ هستهای و بیوتروریسم هرکدام بهنوبه خود میتوانند زمینهساز و تشدیدکننده و یا حتی آغازگر پاندمیهای مرگبار باشند. در حال حاضر بیماری آنفلوانزای پرندگان که پاتوژن آن سویه H5N1 است، بهعنوان کاندید بعدی ایجادکننده پاندمی جهانی موردتوجه قرارگرفته است. بروز این بیماری از سال 2001 تا سال 2012 بهدفعات متعدد در مناطق مختلف گزارششده است و آخرین بروز این بیماری که بهطور رسمی گزارششده مربوط به ماه مارس 2012 در کشور ویتنام بوده که خوشبختانه شیوع این بیماری تا به این لحظه کنترلشده است. بیماری آنفلوانزای پرندگان برای تبدیلشدن به یک پاندمی باید در بین انسانها بهراحتی گسترش و سرایت پیدا کند که خوشبختانه بهجز موارد اسپورادیک که به علت تماس انسان با حیوان بیماری انتقال پیداکرده، سرایت گسترده رخ نداده است. نرخ مرگومیر و یا کشندگی H5N1 بهسادگی قابل پیشبینی نیست اما برخی از تحقیقات نرخ مرگومیر این بیماری رابین 1 تا 60 درصد پیشبینی کردهاند.
تشخیص زمان و مکان بعدی شروع یک پاندمی عفونی، کار بسیار دشواری است، چراکه عوامل بسیاری همچون، جهانیسازی و پیامدهای آن، تغییرات جوی سیاره زمین و نیز تغییر الگوی برهمکنش جوامع انسانی و تغییر الگوهای برخورد انسانها با حیوانات، برآورد احتمالات و پیشبینی را پیچیده و دشوار نموده است. اما این عوامل به همراه دیگر عوامل مؤثر جهانی خطر ایجاد پاندمی را افزایش دادهاند، بهطوریکه کارشناسان احتمال آغاز یک پاندمی همچون H5N1 را نزدیک 15 درصد در خلال یک دوره سهساله، ارزیابی کردهاند.
تکنولوژیهای جدید برای بالا بردن سطح کیفیت زندگی جوامع امروزی بسیار مفید واقعشدهاند و حیات نسل امروزی بشر وابستگی شدیدی به دستاوردهای تکنولوژیکی دارد ولی برخی از این دستاوردهای جدید، میتوانند تهدیداتی برای سلامتی جوامع بشری و حتی ادامه روند حیات آن باشند. سلاحهای بیولوژیک یکی از دستاوردهای تکنولوژیک هستند و ترس از استفاده از این سلاحها در خلال جنگهای نظامی و یا بیوتروریسم بر جامعه بشری سایه افکنده است.
متأسفانه استفاده از عوامل بیولوژیک میتواند مهندسیشده باشد. به عبارتی، با استفاده از روشهای مهندسی ژنتیک میتوان بیماریزایی یک پاتوژن و یا حتی روشهای سرایت و انتقال آن را تغییر داد. از طرفی میتوان از این سلاحها در مکانهایی استفاده کرد که بیشترین میزان سرایت و آلودگی را داشته باشند که شاید تا قبل از آن، شیوع چنین بیماریهایی در آن مناطق معمول نبوده و پیشبینی نمیشدند.
در نیمقرن گذشته پیشرفتهای زیادی در علم ژنتیک مولکولی صورت پذیرفته و دسترسی به تکنولوژیهای دخیل در این علم و یا دستیابی به دست آوردهای آن کار دشواری نیست و همین عامل باعث نگرانی در مورد پاندمیهای مهندسیشده و یا همان بیوتروریسم شده است. درواقع بهوسیله دادههای دیجیتالی توالیهای ژنومی ویروسها که بهراحتی در پایگاههای دادهای اینترنتی وجود دارند، میتوان یک ویروس را ساخت که نمونه همین کار را برای باز ساخت ویروس H1N1 مسئول پاندمی آنفلوانزای 1918 انجام دادند. از طرفی آزمایشگاههای محل تحقیقات زیستی ازجمله تحقیق بر روی پاتوژنها نقش مهمی در سلامت جامعه دارند. با این حال، برخی از اتفاقات و بررسیهای انجامشده توسط محققین گویای آن هستند که این آزمایشگاهها نیز بهنوبه خود پتانسیل خروج پاتوژنهای بالقوه بیماریزا را دارند.
یکی از اهداف برخی از آزمایشگاههای تحقیقاتی ساخت ویروس آنفلوانزای پرندگان بهشدت پاتوژنیک (HPAI) است که انسانها را بهوسیله آئروسل¬های تنفسی آلوده می¬کند. بهعنوانمثال ویروس آنفلوانزای سویه H5N1 برای آلوده کردن موشخرما ساختهشده که درواقع مدل حیوانی اغلب بهعنوان مدل پیشین انسانی استفاده میشود. لین کلوتز در مقاله خود این مطلب را بیان داشته و نیز در ادامه بیان میدارد که نگرانیها در مورد خروج پاتوژنهای ویروس بهشدت پاتوژنیک همانند FLU، SARS و MERS، دولت ایالاتمتحده را بر آن داشته است که حدود و دستورالعملهای مشخصی برای این نوع تحقیقات در قالب سیاستهای تحقیقاتی USG.gain-of-function را اعمال کند که بهروزرسانی آن تا سال 2016 ادامه داشته است. کلوتز اذعان دارد که بر اساس محاسبات او پاندمی ناشی شده از یک فرد آلوده که میتواند از طریق ارتباط با آزمایشگاههای تحقیقاتی آلودهشده باشد، بالقوه توانایی ایجاد پاندمی گسترده را دارد و نیز احتمال یک شیوع غیر کنترلشده دور از انتظار نیست که درنتیجه حاکی از لزوم توجه بیشتر بهاحتمال خروج پاتوژنها از آزمایشگاههای تحقیقاتی است.
البته آزمایشگاههای تحقیقاتی مربوط به پاتوژنها از سطح ایمنی زیستی-4 برخوردار هستند و کارکنانی که در آزمایشگاههای تحقیقاتی با پاتوژنها کار میکنند، واکسینه شده و داروهای ضدویروسی نیز در این سیستم ها در دسترس هستند. درواقع واکسن میتواند همانندسازی ویروس را در یک مورد شاخص کاهش داده و یا شخص را نسبت به سویه خاص از ویروس ایمن کند، اما این به معنای کنترل خروج ویروس از آزمایشگاه نیست، چراکه فرد آلودهشده به ویروس فعال در خلال تماس با مخزن آن، حتی اگر در مقابل آن ویروس خاص واکسینه شده باشد بازهم میتواند به عنوان ناقلی برای خروج ویروس فعال از محدودهی تعیین شده عمل کند که درنتیجه باعث آلودهشدن افراد غیر واکسینه خواهد شد. از طرفی داروهای ضدویروسی نیز محدود بوده و درواقع در مقابل بسیاری از ویروسهای بهشدت پاتوژنیک نظیر آنهایی که تبهای هموراژیک را ایجاد میکنند (ماربورگ، ابولا و…) هیچ داروی مؤثری وجود ندارد.
خروج ویروس آبله در کشور انگلیس در سالهای 1966، 1972 و 1978 از آزمایشگاههای تحقیقاتی، اتفاق افتاد که باعث شد آزمایشگاههای ویروسشناسی بهعنوان یکی از محلهای با پتانسیل ایجاد پاندمی شناخته شوند. این شیوعها به آلودهشدن 80 نفر و مرگ 3 نفر از افراد آلوده انجامید. در خلال این سالها دو آزمایشگاه ویروسشناسی که مجوز رسمی فعالیت نیز داشتند، محل خروج ویروس آبله و آغاز همهگیری آن در کشور انگلیس بودند.
آنفلوانزای انسانی H1N1 باز- ظهور در سال 1977 که ویروس عامل آن از عفونتهای انسانی در ناحیه شرقی اتحادیه جماهیر شوروی (ناحیهای در روسیه امروزی) جدا شد مورد قابلذکر دیگری است. بهعلاوه ایزولههایی از این ویروس نیز از عفونتهای انسانی در ناحیه شمالی کشور چین جدا شد که آنها را با شیوع 1977 در اتحادیه جماهیر شوروی مرتبط میدانستند. آزمایشهای فیلوژنیکی نشان دادند که این سویه جداشده، همان سویه ویروسی سال 1949 بوده که درواقع این سویه نیز تغییریافته سویه آنفلوانزای H1N1 سال 1918 (پاندمی آنفلوانزا) است. آنفلوانزای H1N1 سال 1977 بهسرعت گسترش جهانی یافت و نکته جالب اینجا بود که بیشتر افراد آلوده کمتر از 20 سال سن داشتند که به نظر میرسید افراد مسنتر به علت در معرض قرار گرفتن با این ویروس در سال 1957 ایمنی ذاتی نسبت به آن داشتند.
شیوع این ویروس بیشتر ویروس شناسان را سردرگم کرده بود چراکه، این ویروس هیچ نمونه مشابهی بین ویروسهای آنفلوانزای شناختهشده نداشت.
همین عامل باعث شد که دلیل بروز این ویروس را آزمایشگاههای تحقیقاتی ویروسشناسی بدانند که از سال 1950 به بعد این ویروس را در ذخایر زیستی خود نگهداری میکردند. اما این موضوع توسط دولتهای وقت کشور چین و اتحادیه جماهیر شوروی تکذیب شد.
چندین شیوع ویروس عامل سارس که از آزمایشگاههای ویروسشناسی خارجشده بودند نیز یکی دیگر از موارد قابلذکر است که بعد از شیوع سارس بین سالهای 2003-2002 که نزدیک به 8 هزار نفر در 29 کشور را آلوده کرده و به مرگ 774 نفر از آنها انجامید، اتفاق افتاد. مطالعات نشان دادند که ویروس سارس بهصورت طبیعی باز-ظهور و عودکننده نیست. تحقیقات نشان دادند که ظهور مجدد ویروس ناشی از خروج آن از آزمایشگاههای ویروسشناسی در سنگاپور، تایوان و چین (شهر پکن) بوده که باعث 6 مورد شیوع مجدد ویروس شده است.
درواقع، موارد خروج ویروسها از آزمایشگاههای تحقیقاتی که مورداشاره قرار گرفت حاکی از این است که خروج پاتوژنها از آزمایشگاهها و پتانسیل ایجاد پاندمی تنها یک فرضیه نیست بلکه از درصد احتمال خاص خود برخوردار است. بهعلاوه در نیمقرن گذشته، پیشرفت در علم ژنتیک و علوم سلولی و مولکولی، دستکاریهای ژنتیکی پاتوژنها بهخصوص ویروسها را بسیار تسهیل کرده است و از طرفی افراد متمایل به انجام چنین تحقیقاتی نیز کم نیستند.
اما این نوع تحقیقات همیشه با احتمال خطرآفرینی برای سلامت عمومی همراه هستند. بهعنوانمثال در سال 2001، محققان استرالیایی بهطور تصادفی، ویروس آبله موشی را ایجاد کردند که در مقابل واکسن مقاوم بوده و بهشدت کشنده بود، تا جایی که امروزه تبدیل به کاندیدی برای استفاده بهعنوان سلاح بیولوژیک شده است. هرچند که واژه «تصادفی» برای ساخت چنین پاتوژن مهلکی با این خصوصیات، بهنوبه خود جای بحث دارد. حتی اخیراً دو مقاله بحثانگیز نشاندهنده تحقیق بر روی H5N1 هستند که روند سرایت آن در بین انسانها را تسهیل میکنند. ازاینرو بنیاد چالشهای جهانی (GCF) نگرانی خود را از این تحقیقات ابراز کرده است، چراکه ویروس H5N1 تغییریافته بسیار فاجعه بارتراز سویه وحشی خود خواهد بود. ویروس H5N1 که از سال 1997 تا 2009 باعث مبتلا شدن 20 درصد از مردم جهان شده و جان عدهی زیادی را گرفت، همانطور که پیشتر ذکر شد بهصورت تصادفی از یک آزمایشگاه به خارج راه پیداکرده و حتی منشأ ایجادکننده این سویه از ویروس (H5N1) یک تصادف آزمایشگاهی بوده است و این در حالی است که برخی برآوردها نشان میدهند که سویه H5N1 میتواند نرخ کشندگی 50 درصدی داشته باشد.
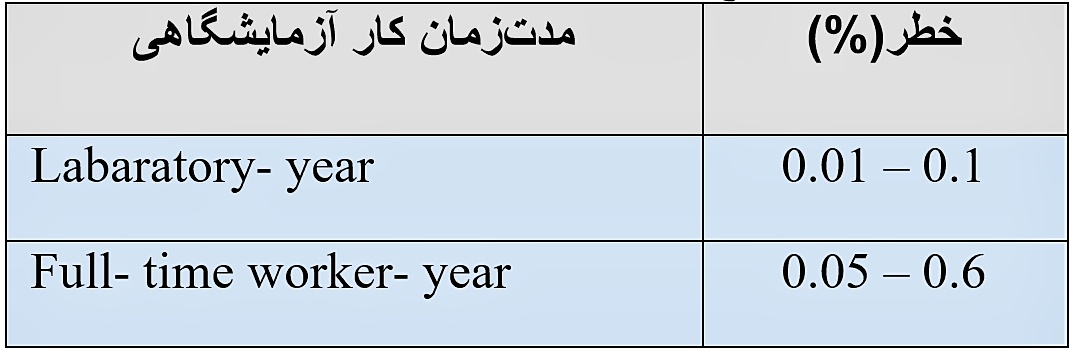
مطالعات دو محقق به نامهای لیپسیچ و اینگلسبی حاکی از این بود که، مدل شبیهسازیشدهای یک عفونت تصادفی ناشی شده از آلودگی کارکنان آزمایشگاه در خلال کاربر روی سویههای جدید و سرایتپذیر آنفلوانزا (همانند سویه H5N1)، نشاندهنده سطوح خطر 10 الی 20 درصدی بوده است و این خطر را میتوان بهصورت از کنترل خارج شدن ویروس و یا شیوع گسترده آن در نظر گرفت. این در حالی است که برخی از مدلهای نرمافزاری در همین زمینه، این خطر را از 5 تا 60 درصد ارزیابی کردهاند. از طرفی برآورده های دو محقق نامبرده شده نشان میدهند که نسبت به مدتزمان کار آزمایشگاهی بر روی سویههای ویروسی سرایتپذیر همانند H5N1 در آزمایشگاهها، بررسی خطر ایجاد پاندمی ناشی از خروج ویروس از آزمایشگاه تحقیقاتی دو بازه عددی بهصورت درصد را نشان میدهد که در جدول (1) درجشدهاند.
جدول 1: خطر ایجاد پاندمی ناشی از خروج ویروس از آزمایشگاه نسبت به مدتزمان کاری در آزمایشگاه
لیپسیچ در مطالعه دیگری در مورد آنفلوانزای H5N1 بیان میکند که این ویروس در حال حاضر، نسبت به دیگر ویروسهای موردتحقیق در آزمایشگاه از بیشترین شانس خطرآفرینی برای سلامت جامعه برخوردار است. درواقع این مطالعات نیز نشاندهنده این هستند که کار تحقیقاتی بر روی پاتوژنهای با پتانسیل ایجاد پاندمی، بهنوبه خود شانس ایجاد پاندمی در جهان را دارد.
علاوه بر این محقق دیگری به نام استفان مرلر و همکارانش نیز در بررسی احتمال خروج تصادفی آنفلوانزا (با پتانسیل ایجاد پاندمی) از آزمایشگاهها به این نتیجه رسیدند که کنترل حوادث تصادفی مربوط به خرج ویروس از آزمایشگاه، تضمینشده نیست و با توجه به افزایش سریع تعداد آزمایشگاههای تحقیقاتی در سراسر جهان، اینیک تهدید جدی برای سلامت جوامع انسانی محسوب میشود.
کلوتز در مطالعه جداگانه دیگری بیان میدارد که محاسبه احتمال خروج ویروس از آزمایشگاهها تحقیقاتی و ایجاد پاندمی، گویای میزان بالای این احتمال است و از آن بهعنوان سناریو worst-case یاد میکند و شانس خروج حداقل یک مورد ویروس، از 10 آزمایشگاه در طول 10 سال در سراسر جهان را نزدیک به 91 درصد برآورد کرده و محاسبه میکند که اگر شانس یک عفونت ناشی شده از آزمایشگاه (LAI) در حدود 30 درصد در سناریو worst-case باشد، شانس پاندمی ناشی از خروج پاتوژن از آزمایشگاه، نزدیک به 27 درصد خواهد بود که شانس بسیار بالایی بوده و خطر بزرگی محسوب میشود و از طرفی احتمال رخداد آن را نیز نمیتوان نادیده گرفت.
سؤال اینجاست که با توجه به روند روزافزون مستعد شدن جهان به شیوع بیماریهای عفونی مختلف، خطر سلاحهای میکروبی و بیوتروریسم و یا خطر بیماریهای نوظهور همچون آنفلوانزای H5N1 و یا سویه H7N7، آبله میمونی و آبله موشی،
آیا انسانها آماده پاندمیهای گسترده هستند؟
درواقع باید پاسخ داد که؛ خیر! در ژانویه سال 2020 میلادی ویروس کووید-19 (کورونا ویروس شبه-سارس) در شهر ووهان در استان هوبی کشور چین شیوع پیداکرده و در کمتر از سه ماه به یک پاندمی جهانی تبدیلشده که تابهحال (27 مارس 2020)، بیش از 540 هزار نفر را در کل جهان آلوده کرده و موجب مرگ بیش از 24 هزار نفر شده است. و با توجه به وضعیت موجود، پیشبینی میشود که تعداد مبتلایان و کشتهشدهها در سطح جهان افزایش چشمگیری داشته باشد.
جدای از گزارشها مقالات علمی که منشأ ویروس را خفاش میدانند و شیوع آن را طبیعی فرض میکنند، شواهدی مستند نیز در دست هستند که توجهات را به انستیتو ویروسشناسی ووهان بهعنوان عامل شیوع بیماری جلب کردهاند. بههرحال، این اتفاق بهخوبی نشان داد که جامعه انسانی آمادگی روبهرویی با چنین چالشهایی از نوع شیوع بیماریهای واگیردار و پاندمی شدن آنها را ندارد. که مهمترین عامل آن علاوه بر نبود دارو و واکسن مؤثر، عدم وجود درک مشترک و آگاهی جمعی و نقصان همکاریها در سطح بینالمللی است.
با فرض اینکه اگر پاندمی بعدی آنفلوانزا بهوسیله سویهای همچون H5N1 رخ دهد، درصورتیکه سویه جهشیافته نباشد، واکسنها تنها توانایی نقطهای و محدودی در پیشگیری و یا کنترل بیماری دارند. چراکه عرضه این واکسنها و ظرفیت تولید آنها محدود است. از طرفی ذخیره داروهای ضدویروسی نیز برای مبارزه با یک پاندمی ناکافی و محدود به چند کشور تولیدکننده این داروها است. بهعلاوه تغییر آنتی ژنتیک ویروس را نیز نباید نادیده گرفت.
از طرفی برآوردها نیز نشان میدهند که نمیتوان همانند اپیدمی سارس، از قرنطینه در برابر اپیدمی آنفلوانزا استفاده کرد. این عدم آمادگی تنها به بیماری آنفلوانزا محدود نمیشود، بلکه جامعه بشری برای شیوع و پاندمی یک بیماری همانند ابولا نیز آماده نیست. درواقع پاندمی ابولا در سال 2014 نیز ثابت کرد که این نگرانی منطقی است، چراکه تنها راه مبارزه با این پاندمی استفاده از یک سیستم قرنطینه گسترده بود که به عبارتی نشاندهنده عدم وجود راهی برای پیشگیری، درمان و یا ریشهکنی بیماری در حل حاضر است. درواقع وضعیت کنونی جامعه بشری در آمادگی برای شیوع اپیدمیها، با سطح بهینه فاصله زیادی دارد. بیماری ابولا علاوه بر کشورهای غرب آفریقا، از طریق مسافرتهای هوایی به ایالاتمتحده آمریکا و اسپانیا راه یافت و تنها راه اساسی مقابله با آن قرنطینه کردن بیماران بود. کشورهایی همچون ساحلعاج و یا آفریقای جنوبی مرزهای خود را بستند و توریستهای دیگر کشورها نیز بعد از معاینه اولیه و بازگشت از آفریقا به مدت 21 روز تحت پایش بودند.
بسیاری از کشورها نیز پروازهای خطوط هوایی خود به غرب آفریقا را قطع کردند. اما واکسن rVSV-ZEBOV در خلال تحقیقات اولیه بر روی حیوانات آزمایشگاهی (جوندگان) اثرات کاملاً رضایت بخشی داشته و ایمنی 100 درصدی را به همراه داشت. نتایج تحقیقاتی در سال 2016 نیز حاکی از موفقیتآمیز بودن آزمایش این واکسن (در حالت ring-vaccination) در کشور گینه (محل شیوع پاندمی ابولا سال 2014) بر روی نمونههای انسانی انتخابشده بهصورت تصادفی و غیر تصادفی، بوده است. بااینوجود همانگونه که پیشتر ذکر شد واکسنها با محدودیتهای مختلفی روبهرو هستند و نیز بهطورمعمول در پیشگیری نقش دارند و به عبارتی ساخت واکسن به معنای دستیابی به روش درمان نیست، اما باید دید که این واکسن توانایی ریشهکن کردن ابولا را دارد و یا خیر؟
در مقابله با یک بیماری نوظهور ساخت یک واکسن بهمحض شیوع بیماری، برای ایمن کردن بخشی از جامعه جهت کنترل اپیدمی با دشواری روبهرو است. ساخت واکسن و تولید انبوه آن به زمان احتیاج دارد. برای ساخت یک واکسن باید چند مرحله طی شود که شامل شناخت پاتوژن جدید، جداسازی آنتیژن و تولید آن، خالصسازی آنتیژن، اضافه کردن دیگر مواد کمکی (ادجوانت)، آمادهسازی سویه واکسن، تست واکسن، معتبر سازی واکسن، تولید در حجم انبوه، کنترل کیفی، پر کردن ویال های واکسن و سپس توزیع آن، میشود. در بهترین شرایط ممکن ساخت یک واکسن و آماده شدن آن برای توزیع در جامعه، به چندین ماه و یا حتی به چندین سال زمان نیاز دارد و این در حالی است که ساخت واکسنها در پاندمیهای جهانی محدود به چند کشور توسعهیافته با سطح تکنولوژیکی بالا است. ازاینرو باید خوشبین بود که در توزیع واکسنها جهتگیریهای سیاسی و اقتصادی نقش نداشته باشند.
بااینوجود برای یک بیماری عفونی که توان ایجاد پاندمی را داشته، حتی چند ماه زمان زیادی است. در دنیای امروز بسیاری از جوامع درحالتوسعه و یا کمتر توسعهیافته هستند که مشکلات اقتصادی این جوامع مانع از گسترش و یا بهبود کمی و کیفی سطح بهداشت در آنها شده است، ازاینرو نمیتوان به توان این کشورها در مقابله با بیماریهای عفونی پاندمیک اعتماد داشت و در بیشتر موارد شیوع بیماریها در این مناطق (بهویژه نواحی جنوب صحرای آفریقا) سازمانهای بینالمللی ناچار به مداخله بودهاند. خطرات ناشی از عفونتهای اکتسابی از آزمایشگاه و نگرانی در مورد شیوع بیماریها و آسیبپذیر بودن جوامع انسانی، باعث شده است که محققانی همچون لیپسیچ و کلوتز، این سؤال را مطرح کنند که آیا کار و تحقیق بر روی پاتوژنهای با پتانسیل ایجاد پاندمی، به خطر بالقوهای که بابت خروج آنها از آزمایشگاه جوامع بشری را تهدید میکند، میارزد و یا خیر؟
درواقع این دو محقق و همکارانشان خواهان مشخص کردن حدود اخلاقی برای تحقیق بر روی پاتوژن های با پتانسیل ایجاد پاندمی بوده و رعایت اصول ایمن و ارتقای ایمنی زیستی و نیز محدود کردن موارد تحقیقاتی بر روی پاتوژن های پاندمیک را برای کاهش احتمال رخ داد این مخاطرات، لازم دانستهاند.
وقتی صحبت از شیوع پاندمی بهعنوان عامل انقراض میشود باید عوامل مؤثر جهانی نیز در نظر گرفته شوند که بهمراتب به آنها اشارهشده است. چراکه کنار هم قرار گرفتن این عوامل به بالا رفتن شانس رخ داد یک پاندمی مرگبار و تشدید اثرات آن کمک چشمگیری میکنند.
از سوی دیگر نباید فقط نگران شیوع یک پاندمی بود بلکه در صورت ادامه روند مستعد سازی بستر شیوع بیماریها، باید نگران شیوع اپیدمیها و یا پاندمیهای مختلف با عوامل پاتوژنی مختلف حتی در بازههای زمانی مشابه بود. مستعدتر شدن جهان به شیوع بیماریها، میتواند بستر را برای شیوع و گسترش بیماریهای عفونی بومی به خارج از منطقه آندمیک آماده کند و این در حالی است که در نقاط مختلف جهان، بیماریهای عفونی بومی با عوامل ویروسی، باکتریایی و انگلی مختلف وجود دارند که برای برخی از مرگبارترین آنها درمان و یا واکسن وجود ندارد. بهعلاوه باید ظهور باکتریهای مقاوم به آنتیبیوتیک را نیز به این موارد اضافه کرد که در دهه اخیر یک مشکل جدی بهحساب میآید.
امروزه نیز شاهد شیوع همزمان چند بیماری عفونی در یک جامعه مشخص هستیم که بهعنوانمثال میتوان به بیماران مبتلا به ایدز اشاره کرد که به توبرکلوزیس نیز مبتلا میشوند و درواقع شیوع دو بیماری عفونی را باهم تجربه میکنند. حداقل یکسوم از جمعیت 34 میلیون نفری مبتلابه ایدز به بیماری توبرکلوزیس نیز مبتلا شدهاند و آن دسته که هر دو بیماری را بهطور همزمان باهم دارند، 21 تا 34 برابر بیشتر توان گسترش بیماری توبرکلوزیس فعال را نسبت به دیگر بیماران ایدزی دارند که به توبرکلوزیس مبتلا نیستند. درواقع بیماری توبرکلوزیس عامل پیشتاز در مرگ بیماران مبتلابه ایدز است. بهعلاوه شیوع یک بیماری و اپیدمی ناشی از آن میتواند باعث کمتوجهی و نادیده گرفتن یک بیماری آندمیک و یا حتی اپیدمیک در یک ناحیه بهطور همزمان شود. بهعنوانمثال شیوع اپیدمی ابولا در سال 2014 در کشور لیبریا باعث شد که تمام توجهات معطوف به این بیماری شده و بیماری ایدز و بیماران مبتلابه آن موقتاً دچار کمتوجهی شوند. بهطوریکه برخی از بیماران جمعیت 30 هزارنفری مبتلابه ایدز از عدم دسترسی به دارو به علت شیوع ابولا، شکایت داشتند.
قبل از شیوع ابولا، 70 درصد از این جمعیت به داروها و سیستمهای پزشکی دسترسی داشتند اما با شیوع ابولا، به علت ترس از انتقال ابولا و حتی کمبود کارکنان بهداشت و محلهای مراقبت از بیماران، بیشتر از 60 درصد از مراکز درمانی، بهناچار درهای خود را بر روی بیماران مبتلابه ایدز بستند. درواقع دور از انتظار نیست که شیوع چند بیماری عفونی باهم و تبدیلشدن آنها به اپیدمی، به ناکارآمد شدن سیستمهای بهداشتی و درمانی بیانجامد.
زندگی در سیارهای که خطرات در همه جای آن و در اشکال مختلف وجود دارند کار بسیار دشواری است. تمام این مخاطرات به یک اندازه مؤثر و یا محتمل نیستند، اما در کنار هم قرار گرفتن آنها و اثرات متقابل آنها بر هم میتواند در تبدیلشدن یک اتفاق ساده به یک فاجعه مرگبار بسیار مؤثر باشد. همانند رخ دادهایی که موجب انقراض برخی از گونههای جانوری در طی دو قرن گذشته شدهاند.
منبع:
شیوع بیماری های عفونی؛با نگاهی به چالش های پیش رو. سجاد بابائی، موسسه آموزشی تالیفی ارشدان، تهران 1396.