فهرست مطالب
[vc_row][vc_column][vc_column_text]
مقدمه
سلول های مورد استفاده در درمان بر پایه سلول (Cell-based therapy) یا سلول درمانی، باید در ویژگی های خاصی از جمله امکان دسترسی راحت، توان تکثیر زیاد و ظرفیت تمایز به رده سلولی مورد نظر (در اینجا کندروسیت) باشند.
سلول مورد استفاده، نباید پس از پیوند، عوارضی نظیر تومور برای بدن ایجاد کند. برای مثال گزارش شده است که پیوند سلول های بنیادی عصبی برای درمان بیماری آتاکسیا تلانژکتازی (Ataxia telangiecta) با ایجاد تومور همراه بوده است (1).
چنین سلول هایی قابل استفاده برای سلول درمانی نیستند. همچنین سلول مورد استفاده نباید، از لحاظ اخلاقی (Ethics) بحث برانگیز باشد. به عنوان مثال تهیه سلول های پرتوان بنیادی جنینی از بلاتوسیست سبب از بین رفتن یک جنین بلاستوسیستی می شود که می توانست به یک موجود زنده کامل (انسان یا حیوان) تبدیل شود.
به همین خاطر از نظر خیلی از منتقدین، به کارگیری این سلول ها از لحاظ اصول اخلاقی پسندیده نیست. از میان انواع سلول ها با پتانسیل استفاده در ساخت سازه غضروفی، سلول های بنیادی مزانشیمی به دلیل برخورداری از برخی ویژگی ها، مورد توجه دانشمندان قرار گرفته است. سلول های بنیادی مزانشیمی در بسیاری از بافت های بدن یافت می شود.
این سلول ها از توان خوبی برای تمایز به کندروسیت برخوردار هستند، براحتی از بافت های بدن جداسازی می شوند، ظرفیت تکثیری بالایی دارند و از لحاظ اخلاقی بحث برانگیز نیستند (از نمونه های بافتی بدون به مخاطره انداختن حیات انسان تهیه می شود). در این فصل ویژگی ها و بیولوژی سلول های بنیادی مزانشیمی مورد بحث قرار خواهد گرفت.
کشف سلول های بنیادی مزانشیمی
احتمال وجود سلول های غیر خون ساز (سلول های بنیادی مزانشیمی) در مغز استخوان، اولین بار حدود 130 سال پیش، با مشاهدات یک پاتولوژیست آلمانی به نام کانهیم (Cohnheim) مطرح گردید. با آزمایش هایی که این دانشمند بر روی ترمیم زخم انجام داد، این فرضیه قوت گرفت که در مغز استخوان سلول های فیبروبلاستی وجود دارد که قادرند در زمان زخمی شدن بخشی از بدن، به محل مهاجرت کرده، با سنتز و ترشح کلاژن به ترمیم آن کمک کنند (2).
تحقیقات فریدن اشتاین (Freidenstein) و همکاران آغازی برای تایید این مطلب بود که مغز استخوان حاوی سلول هایی است که می توانند به سایر سلول های رده مزانشیمی تمایز یابند (3).
این محققین مغز استخوان کامل را در ظروف پلاستیکی کشت دادند و بعد از 4 ساعت سلول های نچسبیده خون ساز را با تعویض محیط کشت خارج ساختند. آنها مشاهده کردند که سلول های چسبنده، جمعیتی غیر یک دست (Herogenous) دارند.
بر اساس گزارش فریدن اشتاین و همکاران، از بین این جمعیت غیر یکدست، برخی ظاهری کشیده و دوکی داشتند و محکم به ظرف کشت چسبیده بودند. این سلول ها به مدت 2 تا 4 روز غیر فعال بودند و بعد از این مدت به سرعت شروع به تکثیر کردند. بعد از انجام چندین پاساژ، سلول های چسبنده یک دست (Homogenous) شدند.همچنین فریدن اشتاین و همکاران دریافتند که سلول های فیبروبلاستی می توانند در محیط کشت به توده های کوچک شبه استخوانی و غضروفی متمایز شوند.
مشاهدات اولیه فریدن اشتاین مبنایی شد تا گروه های تحقیقاتی دیگر در سرتاسر جهان، بر اساس آن، موضوع را بیشتر مورد کند و کاو قرار دهند. نتایج نشان داد سلول هایی که توسط روش فریدن اشتاین جداسازی شده بودند چند توان بوده، پتانسیل تمایز را به استثوبلاست، کندروسیت، ادیپوسیت و حتی میوبلاست دارند (6-4).
در ابتدا سلول های بنیادی مزانشیمی با واژه واحد تولید کولونی – سلول های فیبروبلاستی (Colony Forming Unit-Fibroblastic Cells; CFU-F) نام گذاری شدند که اشاره به مهم ترین ویژگی آنها یعنی توان تولید کولونی دارد (2).
بعدا اسامی دیگری از جمله سلول های داربستی مغز استخوان نیز (Narrow Stromal Cells; MSC) برای اشاره به آنها استفاده شد. در واقع این واژه به داربست مغز استخوان اشاره دارد، اعتقاد بر این است که سلول های بنیادی از آن مشتق شده اند.
امروزه اغلب محققین واژه سلول های بنیادی مزانشیمی (Mesenchymal Stem Cells; MSCs) را برای این سلول ها به کار می برند.
کشت سلول های بنیادی مزانشیمی
مهم ترین ویژگی سلول های بنیادی مزانشیمی در زمان کشت، ایجاد کولونی های فیبروبلاستی است. این ویژگی در زمان کشت با تراکم پایین کاملا مشهود است.
خاصیت تشکیل کولونی نشانگر ظرفیت بالای تکثیری سلول است. اندازه گیری تعداد و سایز کولونی ها، یکی از تست های کمی برای بررسی توان تکثیری سلول های بنیادی مزانشیمی محسوب می شود.
کولونی زایی هم در کشت اولیه و هم در طی پاساژهای سلولی دیده می شود. تعداد کولونی ها در کشت اولیه، معادل تعداد سلول های بنیادی مزانشیمی در نمونه بافتی (مثلا مغز استخوان) است.
مطالعات نشان داده است که در مغز استخوان تعداد واحد تشکیل دهنده کولونی – فیبروبلاست CFU-F (یا همان سلول بنیادی مزانشیمی)، اندک است: به ازای هر 100000-10000 سلول هسته دار، تنها یک سلول CFU-F وجود دارد (7).
اگرچه تعداد سلول های بنیادی مزانشیمی در نمونه های بافتی اندک است، ولی این سلول ها به راحتی قابل تکثیر در شرایط آزمایشگاهی هستند. برای این منظور استفاده از 20-10 درصد سرم جنینی گاو (Fetal Calf Serum; FCS) در محیط کشت اجتناب ناپذیر است.
تحت چنین شرایطی سلول های بنیادی مزانشیمی، پس از یک فاز تاخیری (Lag Phase) کوتاه، به سرعت شروع به تقسیم می کنند (8). دلیل میتوژن بودن سرم گاوی، وجود انواعی از فاکتورهای رشد در آن است.
در این بین فاکتور رشد فیبروبلاستی (FGF-2) از اهمیت زیادی برخوردار است. نشان داده شده است که افزودن این فاکتور به محیط کشت سلول های بنیادی مزانشیمی، تکثیر آن ها را دوچندان کرده، در عین حال ظرفیت تمایزی آن ها را حفظ می کند. به خصوص دیده شده است زمانی که سلول ها بدون این فاکتور کشت داده می شوند، توانایی تمایز به سلول های غضروفی را از دست می دهند (9).
منابع بافتی حاوی سلول های بنیادی مزانشیمی با خاصیت کندروژنیک
گمان بر این است که سلول های بنیادی مزانشیمی در اغلب بافت های بدن وجود دارد (15-10). سه منبع رایج برای تهیه این سلول های شامل مغز استخوان، سینوویوم و بافت چربی است (17،16). بافت های دیگری که این سلول های را می توان از آن ها جدا کرد شامل عضله اسکلتی، خون محیطی و مغز است (20-18).
بافت های تشکیل دهنده بند ناف شامل خون، ورید نافی و ژل وارتون (Wharton’s jelly) از دیگر منابع مهم برای تهیه سلول های بنیادی مزانشیمی محسوب می شوند. در سطور پایین برخی از این منابع بحث خواهد شد.
مغز استخوان جزء اولین منابع مورد استفاده در جداسازی سلولهای بنیادی مزانشیمی می باشد.
این سلول ها در حدود 2-3 درصد از کل سلول های هسته دار مغز استخوان را تشکیل می دهند (21). معمولا نمونه مغز استخوان در انسان و سگ از کرست ایلیاک (Iliac crest) و در اسب از استخوان جناغ (Sternum) تهیه می شود.
بلافاصله پس از تهیه نمونه، باید اسید سیتریک 3 درصد یا هپارین به بافت مغز استخوان اضافه شود تا از لخته شدن آن ممانعت به عمل آید. باید نمونه ها در اسرع وقت، به آزمایشگاه کشت سلول منتقل شود. اولین مرحله جداسازی سلول بنیادی مزانشیمی از مغز استخوان انسان، جدا کردن سلول های هسته دار بافت از سایر سلول هاست.
برای این منظور می توان از سانتریفیوژ شیب غلظت با کمک فایکول (Ficoll) یا پرکول (Percol) استفاده کرد. در ادامه بایستی سلول های هسته دار به محیط کشت منتقل شوند و تحت شرایط استاندارد (5 درصد دی اکسید کربن و 37 درجه سانتی گراد) انکوبه شوند. در جمعیت سلول های تک هسته ای مغز استخوان، علاوه بر سلول های بنیادی مزانشیمی، سلول های بنیادی خون ساز، سلول های تمایز یافته رده خون ساز و احتمالا سلول های آندوتلیال نیز حضور دارند.
خالص سازی سلول های بنیادی مزانشیمی با استفاده از ویژگی چسبندگی آنها انجام می شود. به این صورت که سلول ها در ظرف پلاستیکی کشت و چندین بار پاساژ می شوند. در طی دوره کشت، سلول های بنیادی مزانشیمی به دو دلیل در کشت باقی مانده، سلول های بنیادی مزانشیمی حذف می شوند: 1. سلول ها بنیادی غیر چسبنده بوده، با تعویض محیط کشت دور ریخته می شوند 2.
سلول های تمایز یافته رده خون ساز (نظیر ماکروفاژ) و سلول های آندوتلیال به دلیل اینکه کاملا تمایز یافته هستند، شرایط کشت را تحمل نکرده، در طی پاساژها حذف می شوند. با حذف این سلول ها، سلول های بنیادی مزانشیمی با تشکیل کولونی رشد می کند (22). سلول های بنیادی مزانشیمی مشتق از مغز ستخوان به آسانی در حضور دگزامتازون و فاکتور رشد TGF-B به کندروسیت ها تمایز می یابند (23).
یکی دیگر از منابع بافتی محتوی سلول های بنیادی مزانشیمی، بافت چربی است. این بافت دو خصوصیت جالب توجه دارد: اولا به راحتی با انجام لیپوساکشن قابل تهیه است.
ثانیا تعداد سلول های بنیادی در آن زیاد است. نکته دیگری که این منبع را مورد توجه قرار داده، روش تهیه آن است که با حداقل آسیب ناحیه دهنده همراه است. به منظور جداسازی سلول، ابتدا بافت چربی به مدت 1 تا 2 ساعت با کلاژناز در دمای 37 درجه سانتی گراد هضم آنزیمی می شود.
در ادامه سلول های رها شده از بافت، جمع آوری و در شرایط استاندارد کشت شده و با انجام چندین پاساژ تکثیر می شوند. در طی دوره کشت، سلول های بنیادی مزانشیمی با دو مکانیسمی که برای سلول های مغز استخوان ذکر شد تخلیص می شوند. در حال حاضر تحقیقات گسترده ای بر روی این منبع، در حال انجام است (24).
بافت سینوویوم که لایه داخلی کپسول مفاصل سینوویال را تشکیل می دهد یکی دیگر از بافت های مورد توجه به منظور استخراج سلول های بنیادی مزانشیمی است.
مشخص شده است سلول های بنیادی مزانشیمی مشتق از بافت سینوویوم، پتانسیل استخوان زایی کمتری نسبت به سلول های بنیادی مزانشیمی مشتق از مغز استخوان دارند.
اگر چنین باشد می توان امیدوار بود که چنین سلول هایی بتوانند غضروف پایداری تولید کنند: غضروفی که تمایل کمتری برای هایپرتروفی دارد. در مقابل این مزیت، مهم ترین محدودیت بافت سینوویوم به عنوان منبع سلول های بنیادی مزانشیمی این است که تهیه آن نیاز به یک عمل جراحی دارد (25).
جداسازی و تکثیر سلول های بنیادی مزانشیمی از بافت سینوویوم با هضم آنزیمی آغاز می شود و با جمع آوری سلول های رها شده از بافت و کشت آنها ادامه می یابد.
بافت های بند نافی، انتخاب دیگری است که میتوان از آنها سلول های بنیادی مزانشیمی استخراج کرد. در چندین ساختار این ارگان شامل ژل وارتون و خون بند ناف، سلول بنیادی وجود دارد.
سلول های بنیادی مزانشیمی از ژل وارتون از راه آنزیمی قابل دسترسی است، در حالی که در مورد خون بند ناف، نیازی به استفاده از آنزیم نبوده، سلول ها با انجام سانتریفیوژ و کشت قابل تهیه هستند.
از خصوصیات جالب سلول های بنیادی مزانشیمی ژل وارتون این است که آنتی ژن های (Major Histocompatibility Complex; MHC) کلاس I و II را بیان نمی کنند.
این ویژگی باعث شده که سلول های مذکور جایگاه ویژه ای در بحث پیوند داشته باشند. سلول های بنیادی مزانشیمی ژل وارتون براحتی در حضور فاکتورهای کندروژنیک به غضروف متمایز می شوند. بر اساس مطالعات، 4 هفته پس از کشت در شرایط غضروفزایی، این سلول ها قادرند کلاژن نوع II و گلیکوزآمینوگلایکان های غضروفی را در حد قابل توجهی سنتز و ترشح کنند (26).
با توجه به اهمیت زیاد خون بند ناف، امروزه بانک هایی برای این بافت و سلول های بنیادی آن در سرتاسر جهان تاسیس شده است. این بانک ها با تشویق والدین در نگه داری سلول های خون بند ناف فرزند خود، گامی مهم در جهت کاربرد این سلول ها در طب ترمیم برداشته اند.
استفاده از سلول های بنیادی خون بند ناف در برخی حیوانات نظیر اسب های مسابقه ای که گران قیمت هستند نیز اهمیت دارد، به طوری که برخی محققین سعی کرده اند از پتانسیل این سلول ها در درمان آسیب های مفصلی این حیوان بهره برداری نمایند (27).
آنتی ژن های سطحی یا شاخص ها(مارکرها)ی مولکولی سلول های بنیادی مزانشیمی
یکی از شاخصه های مهم که می توان با بهره گیری از آن سلول ها را شناسایی و تعریف کرد، آنتیژن های سطح سلولی است. واقعیت امر این است که تاکنون تلاش های بسیاری برای تعیین پروفایل آنتی ژن های سطحی سلول های بنیادی مزانشیمی صورت گرفته است.
اکثر مطالعات بر روی سلول های بنیادی مزانشیمی جدا شده از مغز استخوان انسان و موش متمرکز بوده اند، البته برخی نیز سلول های جدا شده از سایر بافت ها را مورد توجه قرار داده اند.
در مجموع مارکر سطح سلولی منفردی برای سلول های بنیادی مزانشیمی معرفی نشده، بلکه مشخص شده است که این سلول ها برخی مارکرها را بیان و برخی دیگر را بیان نمی کنند (28). جدول 1 بیان یا عدم بیان 16 پروتئین سطحی در سلول های بنیادی مزانشیمی انسانی را نشان می دهد.
| آنتی ژن سطحی | بیان یا عدم بیان |
|
Stro-1,CD13, CD 29, CD 44, CD73, CD 105 CD 106 |
آنتی ژن های سطحی که بیان می شوند |
| CD 11b, CD31, CD 34, CD 45, CD 117 | آنتی ژن های سطحی که بیان نمی شوند |
| Sca-1, CD10, CD 90, Flk-1 |
آنتی ژن های سطحی که گاهی بیان شده و گاهی بیان نمی شوند |
خودنوزایی سلول های بنیادی مزانشیمی (MSC self-renewal)
خودنوزایی یکی از ویژگی های شاخص هر سلول بنیادی است. این توانایی، سلول ها را قادر می سازد در حالی که پتانسیل تمایزی خود را حفظ می کنند با تقسیم میتوزی، فرزندانی مشابه با خود را ایجاد نمایند.
قابلیت تکثیر سلول های بنیادی مزانشیمی، به لحاظ مهندسی بافت نیز اهمیت ویژه ای برخوردار است، زیرا بدون آن تعداد سلول های برای ایجاد یک سازه مهندسی شده، کافی نخواهد بود. پیش نیاز تقسیمات خودنوزایی، حفظ وضعیت تمایز نیافتگی سلول است. به عبارت دیگر سلولی که مسیر تمایز را پیش میگیرد، قادر به تقسیم نیست.
برای حفظ حالت تمایز نیافتگی (بنیادینگی) سلول، مکانسیم های بیولوژیکی لازم است که معمولا با فعال شدن هماهنگ چندین مسیر سیگنال دهی به کار می افتند (35). تاکنون مطالعات بسیاری برای تعیین ژن ها و ساختارهای مولکولی دخیل در حفظ بنیادینگی سلول ها از جمله سلول های بنیادی مزانشیمی صورت گرفته است (36). بر اساس یافته های این تحقیقات تا حدودی نقش ژن های دخیل در اعطای ویژگی خودنوزایی به سلول های بنیادی مزانشیمی مشخص شده است .
سلول های بنیادی در داخل بدن در حالت خاموشی و استراحت بوده، در شرایط خاص مانند آسیب و جراحت، بر اثر محرک های میتوژنی محیطی وارد چرخه سلولی می شوند و بسته به نوع محرک به طور متقارن یا نامتقارن تقسیم می گردند. محرک های میتوژنی تاثیرات خود را از طریق فعال کردن مسیرهای سیگنالی مانند Notch، Wnt و BMP اعمال می کنند.
مسیر Wnt یکی از مسیرهای مهم درگیر در تکثیر سلولی است. این مسیر می تواند تکثیر سلول های بنیادی را در لایه اپیدرم پوست، روده، خون ساز و عصبی موجب شود. هم چنین نشان داده شده است که فعال شدن مسیر WNT تمایز را در سلول های بنیادی جنینی مهار می کند (37).
مسیر Wnt تاثیرات خود را از طریق بتاکاتنین (β-catenin) اعمال می کند، بدین صورت که فعال شدن این مسیر در نهایت منجر به افزایش میزان بتاکاتنین در داخل سلول شده، این پروتئین به نوبه خود موجب بیان فاکتورهای رونویسی مانند c-Myc می گردد که در تکثیر نقش دارند. نشان داده شده است که Wnt، خودنوزایی سلول های بنیادی مزانشیمی را نیز تنظیم می کند.
حضور پروتئین Wnt3a (عامل فعال شدن مسیر Wnt) در کشت سلول های بنیادی مزانشیمی، موجب افزایش تکثیر و مهار تمایز استئوژنیک آنها می شود (38). هم چنین Cho و همکاران نشان داده اند که کشت سلول های بنیادی مزانشیمی مشتق از بافت چربی در محیط حاوی Wnt3a با افزایش میزان بتاکانتین و سرعت تکثیر همراه است (39).
برخی فاکتورهای رشد و سایتوکاین ها نظیر عامل مهاری لوکمی(Leukemia Inhibitory Factor; LIF) (40،13) و عامل رشد فیبروپلاستی (FibroblastGrowthFactor; FGF) (42،41) نیز در حفظ حالت بنیادینگی سلول های بنیادی مزانشیمی نقش دارند. با افزودن این عوامل به محیط کشت پایه (مانند افزودن FGF-2) توان تکثیری سلول های بنیادی مزانشیمی افزایش می یابد (43).
تداوم تقسیمات خودنوزایی سلول های بنیادی مزانشیمی، در گرو حفظ حالت بنیادینگی سلول است. بنیادینگی سلول به نوبه خود با بیان برخی ژن ها نظیر Sox-2، Rex-1 حفظ می شود.
ژن های مذکور از مارکرهای سلول های بنیادی جنینی محسوب می شوند ولی در برخی مطالعات بیان آنها در سلول های بنیادی مزانشیمی نیز گزارش شده است (44). در سلول های بنیادی جنینی مشتق از موش نشان داده شده است که پروتئین های Polycomb chromatin-associated proteins در مهار ژن های تمایزی نقش دارند و در نتیجه به حفظ بنیادینگی سلول کمک می کنند (45).
در حقیقت این پروتئین ها هستند که ممکن است به صورت غیر مستقیم موجب بقاء فعالیت Sox2، Oct-4 و Rex-1 گردند. هم چنین، پروتئین های Trithorax که کمپلمان پروتئین های Polycomb هستند نیز با فعال ساختن ژن های همئوتیک ممکن است به صورت مستقیم تنظیم بیان ژن های Sox-2، Oct-4 و Rex-1 را موجب گردند (46).
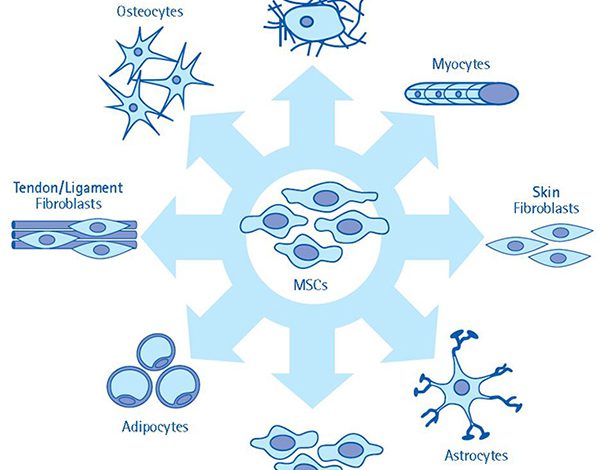
تمایز سلول های بنیادی مزانشیمی (MSC Differentiation)
توان تمایز به رده های اسکلتی (استخوان، غضروف و چربی) از ویژگی های شاخص سلول های بنیادی مزانشیمی محسوب می شود. این توانایی از لحاظ مهندسی بافت و طب ترمیم نیز از اهمیت به سزایی برخوردار است. برای اینکه سازه بافتی بهینه و کارآیی ساخته شود، لازم است تمایز سلول به صورت کنترل شده انجام شود تا از تمایزهای ناخواسته آنها جلوگیری گردد.
تمایز سلولی فرایند پیچیده ای است که به دنبال فعال شدن مسیرهای سیگنال دهی ویژه و بیان ژن های تنظیمی به وقوع می پیوندد. مکانسیم دقیق تنظیم کننده تمایز هنوز به صورت ناشناخته باقی مانده، یکی از چالش های بزرگ این حوزه به شمار می آیند. شناخت دقیق مسیرهای دخیل در تمایز سلول های بنیادی مزانشیمی و مولکول های تنظیمی که هدایت این مسیرها را عهده دار هستند، یکی از زمینه های فعال تحقیقاتی محسوب می شود.
ویژگی های ایمونولوژیکی سلول های بنیادی مزانشیمی
سلول های بنیادی مزانشیمی از نظر ایمونوژنیک دارای ویژگی منحصر به فردی هستند که آنها را به عنوان یک دهنده عمومی برای کاربردهای درمانی مطرح می کند. این سلول ها با دارا بودن فنوتیپی خاص در هنگام رویارویی با سلول های ایمنی گیرنده آلوژن، مانع از القاء واکنش ایمنی شده، در نتیجه پیوند مزانشیمی به صورت CD86-، CD80، CD40-، MHCII-،MHC I+ می باشد(48).
رد پیوند توسط سیستم ایمنی میزبان، معمولا به دنبال فعال شدن و تکثیر سلول های T و تبدیل آنها به سلول های افکتور انجام می شود (49). فعال شدن لنفوسیت های T به واسطه مولکول های MHC کلاس I و نیز مولکول های CD80 و CD86 که مسئول ایجاد سیگنال های Co-stimulatory هستند، اتفاق می افتد.
نظر به اینکه سلول های بنیادی مزانشیمی فاقد مولکول های Co-stimulatory هستند، لنفوسیت های T را فعال نکرده، در نتیجه پیوند آلوژن این سلول ها با واکنش ایمنی بدن گیرنده همراه نیست (27).
طبیعت سرکوب کنندگی سیستم ایمنی سلول های بنیادی مزانشیمی، با مطالعاتی که بر روی مدل های حیوانی مانند مدل بابون (baboon) skin allograft model انجام گرفته، کاملا به اثبات رسیده است.
سلول های بنیادی مزانشیمی با ترشح فاکتورهای محلولی نظیر (indoleamine 2,3-Dioxygenase) IDO، نیتریک اسید،TGF- و پروستا گلاندین E2، تاثیرات مهاری بر تکثیر لنفوسیت های T,CD4+ و CD8+ دارند (53-50). همچنین نشان داده شده است که این سلول ها باعث متوقف شدن چرخه سلولی لنفوسیت های B در فاز G0/G1 ، مهار تمایز این سلول ها به سلول های پلاسمایی (Plasma Cells) و مهار کموتاکسی آنها می گردند(44،45).
اعتقاد بر این است که تاثیر سلول های بنیادی مزانشیمی در کاهش فعالیت لنفوسیت های B در بدن، به واسطه مهار سلول های T انجام شود(46). در مطالعه ای رامازامی (Ramasamy) و همکاران نشان داده اند سلول های بنیادی مزانشیمی، هم چنین تمایز سلول های دندریتیک (Dendritic cells; DCs) را مهار کرده، در ضمن مانع ورود آنها به چرخه سلولی می گردند (47).
سلول های دندریتیک به دلیل توانایی شان در ارائه بسیار موثر آنتی ژن ها به لنفوسیت ها به عنوان رابط اصلی میان ایمنی ذاتی و اکتسابی به شمار می آیند. سلول های بنیادی مزانشیمی بر روی منوسیت ها نیز تاثیرات مهاری دارند. نشان داده شده است که در حضور سلول های بنیادی مزانشیمی، منوسیت ها توانایی تبدیل به سلول های دندریتیک را ندارند(48).
با توجه به ویژگی سرکوب کنندگی سیستم ایمنی سلول های بنیادی مزانشیمی، امیدهای زیادی در جهت استفاده گسترده از این سلول ها در طب ترمیمی ایجاد شده است.
به طوری که برخی محققین تلاش کرده اند از این خاصیت سلول ها، در جهت کاهش احتمال رد پیوند آلوژنیک سلول های بنیادی خون ساز و نیز درمان عارضه (Graft-Versus-Host Disease; GVHD) بهره برداری نمایند. دانشمندان امیدوار هستند که در آینده بتوان از سلول های بنیادی مزانشیمی به عنوان یک منبع سلولی دهنده عمومی، در ترمیم بافت ها استفاده کرد (50،49).
ویژگی های درمان بخش
بدون شک از مهمترین و در عین حال صعب الوصول ترین مزیت سلول های بنیادی مزانشیمی استفاده از پتانسیل های درمانی این سلول هاست. از میان صدها پژوهش انجام شده در خصوص این سلول ها شاید بتوان به طور اجمالی گفت که به دلایل زیر در زمینه های درمانی، سلول های بنیادی مزانشیمی اهمیت ویژه ای دارند (50).
توانایی قرار گرفتن در محل التهاب در زمان جراحات بافتی پس از تزریق را دارند.
به انواع رده های مختلف سلولی قابل تمایزند.
مولکول های چند گانه ی فعال زیستی که توانایی القاء بهبودی در سلول های آسیب دیده را دارند ترشح می کنند و از التهاب جلوگیری می کنند.
فعالیت های تعدیل کنندگی ایمنی دارند (50).
آنچه مسلم است با بهره گیری از خصوصیات فوق طراحی های مختلف درمانی با نتایج مختلف و البته امیدوارکننده ای در بسیاری از تحقیقات انجام گرفته که در بین درمان های امتحان شده، پیوندها از تعدد و اهمیت بالایی برخوردارند. نقش MSCs در درمان GVHD در دهه گذشته، در مطالعاتی با تعداد متفادتی از بیماران و درجات مختلفی از تاثیر GVHD پس از پیوند کبد، روده و پوست بررسی شده است و نتایج نشان دهنده ی این است که MSCs ممکن است درمان جدیدی برایGVHD محسوب شوند (52،51).
از موضاعات جذاب و نسبتا امیدوارکننده استفاده این سلول ها در بیماران قلبی است که در برخی مطالعات اثرات درمانی MSCs برای بیماری های قلبی عروقی مشاهده شده است. هر چند که مکانیسم درگیر ناشناخته می باشد و اثرات درمانی نه تنها از طریق تمایز MSCs به کاردیومیوسیت ها بلکه از طریق ترشح مقدار زیادی از مولکول های فعال زیستی نشان داده شده است. هر چند عدم تاثیر معنی دار یا عوارضی همچون پارگی میوکارد نیز پس از پیوند این سلول ها گزارش گردیده است (53).
شاید امیدوارکننده و کم عارضه ترین مورد مصرف درمانی این سلول ها در زمینه بیماری های غضروفی و استخوان در نظر گرفته شود. در درمان آرتروز مطالعاتی صورت گرفته و برای مثال در مطالعات متعددی این نتیجه حاصل شد که تزریق اینتراآرتیکولار سلول های بنیادی مزانشیمی در آرتروز زانو علائم این ضایعه را کاهش و میزان رضایت مندی بیماران را افزایش داده است (53).
به علاوه در مطالعاتی گزارش شده است که سلول های بنیادی مزانشیمی جلوی رشد تومورها و متاستاز را می گیرد (50).
درمان هایی با واسطه ی سلول های بنیادی مزانشیمی در مورد ضایعات عصبی، پانکراس، چشم و گنادها هم چنان در حال پیشرفت بوده و در بین محققین از محبوبیت زیادی برخوردار شده هر چند پیچیدگی های درمانی در مورد نتایج ان همچنان بر جای مانده است.
تحقیقات مورد نیاز در زمینه سلول های بنیادی مزانشیمی
همان گونه که پیش تر اشاره شد سلول های بنیادی مزانشیمی از ابعاد و جنبه های مختلف در سال های اخیر مورد مطالعه و بررسی قرار گرفته اند، ولی موضوعاتی در زمینه سلول های بنیادی مزانشیمی وجود دارد که به میزان کمتری به آن ها پرداخته شده است. از جمله معایب استفاده از سلول های بنیادی مزانشیمی باقی نماندن سلول در محل پیوند به دلیل خصوصیت مهاجرت یا آپوپتوز است. همچنین چر هزینه بودن مراحل کشت، نیاز به مراقبت مداوم و محدود و مخدوش شدن کشت به دلیل آلودگی، عدم وجود مواد کامل اولیه کشت به صورت ارزان، نیمه عمر پایین مواد بیومتریال و حمل و نقل مشکل از دیگر معایب آن می باشد و در این زمینه تحقیقات بیشتری مورد نیاز است. برخی محققین که در زمینه ی استخراج MSC ها فعالیت دارند در خصوص تفاوت رشد و تکثیر سلول ها در فصول مختلف سال نشانه هایی را مشاهده کرده اند که این موضوع نیز نیاز به بررسی های بیشتری دارد. در کلینیک نیز دسترسی به تعداد زیاد سلول جهت تزریق و نیاز به انجام پاساژهای متعدد، منجر به کاهش طول تلومر، پیری و غیر فعال شدن سلول می گردد.
در مقابل یکی از مهم ترین خصوصیات سلول های بنیادی مزانشیمی انسانی (hMSCs)، توانایی بقا در چگالی پایین در محیط کشت فاقد سرم است. در خصوص این مسئله هم اطلاعات به دست آمده بسیار محدود است. این سلول ها در شرایط فاقد سرم مارکرهای سطحی خود را بیان کرده و توانایی تمایز به رده های مزودرمی و ازدیاد در شرایط اضافه کردن مجدد سرم به محیط کشت را دارا هستند. از این خصوصیت سلول های بنیادی مزانشیمی انسانی برای گسترش و تمایز این سلول ها در محیط کشت فاقد سرم و غنی شده با فاکتورهای رشد استفاده می شود (49).
نتیجه گیری
نقش درمانی سلول های بنیادی مزانشیمی در بیماری های تخریب کننده و خودایمنی اثبات رسیده است. از طرفی با توجه به چالش های پیش رو در استفاده از این سلول ها در سلول درمانی، می توان با رعایت استانداردها (بر اساس دستورالعمل ها) در آینده استفاده گسترده ای از این سلول ها در کلنیک انجام داد.
منابع:
1. N. Amariglio, A. Hirshberg, B. W. Scheithauer et al., «Donor-derived brain tumor following neural stem cell transplantation in an ataxia telangiectasia patient,» PLoS Med, vol. 6, no. 2, pp. e1000029, 2009.
2. D. J. Prockop, «Marrow stromal cells as stem cells for nonhematopoietic tissues,» Science, vol. 276, no. 5309, pp. 71-74, 1997.
3. A. J. Friedenstein, J. F. Gorskaja, N. N. Kulagina, «Fibroblast precursors in normal and irradiated mouse hematopoietic organs,» Exp Hematol, vol. 4, no. 5, pp. 267-274, 1976.
4. B. A. Ashton, T. D. Allen, C. R. Howlett et al., «Formation of bone and cartilage by marrow stromal cells in diffusion chambers in vivo,» Clin Orthop Relat Res, vol., no. 151, pp. 294-307, 1980.
5. I. Bab, B. A. Ashton, D. Gazit et al., «Kinetics and differentiation of marrow stromal cells in diffusion chambers in vivo,» J Cell Sci, vol. 84, no., pp. 139-151, 1986.
6. H. Castro-Malaspina, R. E. Gay, G. Resnick et al., «Characterization of human bone marrow fibroblast colony-forming cells (CFU-F) and their progeny,» Blood, vol. 56, no. 2, pp. 289-301, 1980.
7. A. J. Friedenstein, R. K. Chailakhjan, K. S. Lalykina, «The development of fibroblast colonies in monolayer cultures of guinea-pig bone marrow and spleen cells,» Cell Tissue Kinet, vol. 3, no. 4, pp. 393-403, 1970.
8. D. C. Colter, R. Class, C. M. DiGirolamo et al., «Rapid expansion of recycling stem cells in cultures of plastic-adherent cells from human bone marrow,» Proc Natl Acad Sci U S A, vol. 97, no. 7, pp. 3213-3218, 2000.
9. M. Mastrogiacomo, R. Cancedda, R. Quarto, «Effect of different growth factors on the chondrogenic potential of human bone marrow stromal cells,» Osteoarthritis Cartilage, vol. 9 Suppl A, no., pp. S36-40, 2001.
10. C. Campagnoli, I. A. Roberts, S. Kumar et al., «Identification of mesenchymal stem/peogenitor cells in human first-trimester fetal blood, liver, and bone marrow,» Blood, vol. 98, no. 8, pp. 2396-2402, 2001.
11. P. S. In tAnker, S. A. Scherjon, C. Kleijburg-van der Keur et al., «Amniotic fluid as a novel source of mesenchymal stem cells for therapeutic transplantation,» Blood, vol.102, no. 4, pp. 1548-1549, 2003.
12. H. Nakahara, J. E. Dennis, S. P. Bruder et al., «In vitro differentiation of bone and hypertrophic cartilage from periosteal-derived cells,» Exp Cell Res, vol. 195, no.2, pp. 492-503, 1991.
13. P. A. Zuk, M. Zhu, P. Ashjian et al., «Human adipose tissue is a source of multipotent stem cells,» Mol Biol Cel, vol. 13, no. 12, pp. 4279-4295, 2002.
14. L. Marinova-Mutafchieva, P. Taylor, K. Funa et al., «mesenchymal cells expression bone morphogenetic protein receptors are present in the rheumatoid arthritis joint,» Arthritis Rheum, vol. 43, no. 9, pp. 2046-2055, 2000.
15. E. H. Javazon, K. J. Veggs, A. W Flake, «mesenchymal stem cell: paradoxes of passaging,» Exp Hematol, vol. 32, no. 5, pp. 414-425, 2004.
16. C. De Bari, F. Dell’Accio, P. Tylzanowski et al,. «Multipotent mesenchymal stem cells from adult human synovial membrane,» Arthritis rheum, vol. 44, no. 8, pp. 1928-1942, 2001.
17. S. Fickert, J. Fiedler, R. E. Brenner, «Identification, quantification and isolation of mesenchymal progenitor cells from osteoarthritic synovium by fluorescence automated cell sorting,» Osteoarthritis Cartilage, vol. 11, no. 11, pp. 790-800, 2003.
18. J. Bujan, G. Pascual, C. Corrales et al., «Muscle-derived stem cell used to treat skin defects prevent wound contraction and expedite reepithelialization,» Wound Repair Regen, vol. 14, no. 2, pp. 216-223, 2006.
19. G. Y. Rochefort, B. Delorme, A. Lopez et al., «Multipotential mesenchymal stem cells are mobilized into peripheral blood by hypoxia,» Stem Cells, vol. 24, no. 10, pp. 2202-2208, 2006.
20. Y. Jiang, B. Vaessen, T. Lenvik et al., «Multipotent progenitor cells can be isolated from postnatal murine bone marrow, muscle, and brain,» Exp Hematol, vol. 30, no. 8, pp. 896-904, 2002.
21. M. F. Pittenger, A. M. Mackay, S. C. Beck et al., «Multilineage potential of adult human mesenchymal stem cells,» Science, vol. 284, no. 5411, pp. 143-147, 1999.
22. C. Csaki, U. Matis, A. Mobasheri et al., «Chondrogensis, osteogenesis and adipogenesis of canine mesenchymal stem cells: a biochemical, morphological and ultrastructural study,» Histochem Cell Biol, vol. 128, no. 6, pp. 507-520, 2007.
23. M. E. Bernardo, J. A. Emons, M. Karperien et al., «Human mesenchymal stem cells derived from bone marrow display a better chondrogenic differentiation compared with other sources,» Connect Tisshue Res, vol. 48, no. 3, pp. 132-140, 2007.
24. M. N. Helder, M. Knippenberg, J. Klein-Nulend et al., «Stem cells from adipose tissue allow challenging new concepts for regenerative medicine,» Tissue Eng, vol 13, no. 8, pp. 1799-1808, 2007.
25. K. Nishimura, L. A. Solchaga, A. I. Caplan et al., «Chondroprogenitor cells of synovial tissue,» Arthritis Rheum, vol. 42, no. 12, pp. 2631-2637, 1999.
27. T. G. Koch, T. Heerkens, P. D. Thomsen et al., «Isolation of mesenchymal stem cells from equine umbilical cord blood,» BMC Biotechnol, vol. 7, no., pp. 26, 2007.
28. Y. jiang, B. N. Jahagirdar, R. L. Reinhardt et al., «Pluripotency of mesencymal stem cells derived from adult marrow,» Nature, vol. 418, no. 6893, pp. 41-49, 2002.
29. A. V. Molofsky, R. Pardal, S. J. Morrison, «Diverse mechanisms regulate stem cell self-renewal,» Curr Opin Cell Biol, vol. 16, no. 6, pp. 700-707, 2004.
30. L. Song, N. E. Webb, Y. Song et al., «Identification and functional analysis of candidate genes regulating mesenchymal stem cell self-renewal and multipotency,» Stem Cells, vol. 24, no. 7, pp. 1707-1718, 2006.
31. M. Kleber, L. Sommer, «Wnt signaling and the regulation of stem cell function,» Curr Opin Cell Biol, vol. 16, no. 6, pp. 681-687, 2004.
32. G. M. Boland, G. Perkins, D. J. Hall et al., «Wnt 3a promotes proliferation and suppresses osteogenic differentiation of adult human mesenchymal stem cells,» J Cell Biochem, vol. 93, no. 6, pp. 1210-1230, 2004.
33. H. H. Cho. Y. J. Kim, S. J. Kim et al., «Endogenous Wnt signaling promotes proliferation and suppresses osteogenic differentiation in human adipose derived stromal cells,» Tissue Eng, vol. 12, no. 1, pp. 111-121, 2006.
34. D. Metcalf, «The unsolved enigmas of leukemia inhibitory factor,» Stem Cells, vol. 21, no. 1, pp. 5-14, 2003.
35. S. Tsutsumi, A. Shimazu, K. Miyazaki et al., «Retention of multilineage differentiation potential of mesenchymal cells during proliferationin response to FGF,» Biochem Biophys Res Commun, vol. 288, no. 2, pp. 413-419, 2001.
36 .L. E. Zaragosi, G. Ailhaud, C. Dani, «Autocrine fibroblast growth factor 2 signaling is critical for self-renewal of human multipotent adipose-derived stem cells,» Stem Cells, vol. 24, no. 11, pp. 2412-2419, 2006.
37. G. Bianchi, A. Banfi, M. Mastrogiacomo et al., «Ex vivo enrichment of mesenchymal cell progenitors by fibroblast growth factor 2,» Exp Cell Res, vol. 287, no. 1, pp. 98-105, 2003.
38. R. Izadpanah, C. Trygg, B. Patel et al., «Biologic properties of mesenchymal stem cells derived from bone marrow and adipose tissue,» J Cell Biochem, vol. 99, no. 5, pp. 1285-1297, 2006.
39. L. A. Boyer, K. Plath, J. Zeitlinger et al., «Polycommb complexes repress developmental regulators in murine embryonic stem cells,» Nature, vol. 441, no. 7091, pp. 349-353, 2006.
40. L. Ringrose, R. Paro, «Epigenetic regulation of cellular memory by the Polycomb and Trithorax group proteins,» Annu Rev Genet, vol. 38, no., pp. 413-443, 2004.
41. G. Chamberlain, J. Fox, B. Ashton et al., «Concise review: mesenchymal stem cells: their phenotype, differentiation capacity, immunological fewtures, and potential for homing,» stemcells, vol. 25, no. 11, pp. 2739-2749, 2007.
42. B. M. Hall, S. Dorsch, B. Roser, «The cellular basis of allograft rejection in vivo. I. The cellular requirements for firs-set rejection of heart grafts,» J Exp Med, vol. 148, no. 4, pp. 88-889, 1978.
43. A. Bartholomew, C. Sturgeon, M. Siatskas et al., «Mesenchymal stem cells suppress lymphocyte proliferation in vitro and prolong skin graft survival in vivo,» Exp Hematol, vol. 30, no. 1, pp. 42-48, 2002.
44. M. Di Nicola, C. Carlo-Stella, M. Magni et al., «Human bone marrow stromal cells suppress T-lymphocyte proliferation induced by cellular or nonspecific mitogenic stimuli,»Blood, vol. 99, no. 10, pp. 3838-3843, 2002.
45. O. DelaRosa, E. Lombardo, A. Beraza et al., «Requirement of IFN-gamma-mediated in-doleamine 2,3-dioxygenase expression in the modulation of lymphocyte proliferation by human adipose-derived stem cells,» Tissue Eng Part A, vol. 15, no. 10, pp. 2795-2806, 2009.
46. J. M. Ryan, F. Barry, J. M. Murphy et al., «lnterferon-gamma does not break, but promotes the immunosuppressive capacity of adult human mesenchymal stem cells,» Clin Exp Immunol, vol. 149, no. 2, pp. 353-363, 2007.
47. A.Corcione, F. Benvenuto, E. Ferretti et al., «Human mesenchymal stem cells modulate B-cell functions,» Blood, vol. 107, no. 1, pp. 367-372, 2006.
48. S.Asari, S.ltakura, K. Ferreri et al., «Mesenchymal stem cells suppress B-cell terminal differentiation,» Exp Hematol, vol. 37, no. 5, pp. 604-615, 2009.
49. E. Gerdoni, B. Gallo, S. Casazza et al., «Mesemchymal stem cells effectively modulate pathogenic immune response in experimental autoimmune encephalomyelitis,» Ann Neural, vol. 61, no. 3, pp. 219-227, 2007.
50. R. Ramasamy, H. Fazekasova, E. W. Lam et al., «Mesemchymal stem cells inhibit dendritic cell differentiation and function by preventing entry into the cell cycle,» Transplantation, vol. 83, no. 1, pp. 71-76, 2007.
51. W. Zhang, W. Ge, C. Li et al., «Effects of Mesemchymal stem cells on differentiation, maturation, and function of human monocyte-derived dendritic,» Stem Cells Dev, vol. 13, no. 3, pp. 263-271, 2004.
52. H. M. Lazarus, O. N. Koc, S. M. Devine et al., «Cotransplantation of HLA-identical sibling culture-expanded mesenchymal stem cells and hematopoietic stem cells in hematologic malignancy patients,» Biol Blood Marrow Transplant, vol. 11, no. 5m pp. 389-398, 2005.
53. K. Le Blanc, I. Rasmusson, B. Sundberg et al., «Treatment of severe acute graft-versus-host disease with third party haploidentical mesenchymal stem cells,» Lancet, vol. 363, no. 9419, pp. 1439-1441, 2004.
گرد آوری و تالیف: طناز سخاورز
[/vc_column_text][/vc_column][/vc_row]



یک نظر