فهرست مطالب
تقویت وابسته به بستن چندگانه یا با نام اصلی “Multiplex ligation dependent probe amplification” که به اختصار MLPA گفته میشود، یک تکنیک اخیرا توسعه یافته است که قادر به اثبات تغییرات در تعداد کپی چندین ژن انسان است.
MLPA، تکنیکی است که در آن از جفت پروب برای تشخیص بخشهای خاصی از ژنوم و شناسایی تنوع تعداد کپی در سطح اگزون استفاده میشود. باتوجه به این توانایی، MLPA میتواند در تشخیص مولکولی چندین بیماری ژنتیکی که پاتوژنز آنها به وجود حذف یا تکرار ژنهای خاص مربوط میشود، استفاده کرد.
از تکنیک MLPA معمولا برای تشخیص شرایطی که عموما ناشی از تغییرات تعداد کپی در سطح اگزون (حذفها و تکراریها) هستند، استفاده میکنند. از طرفی دیگر از این تکنیک میتوان ترکیب با توالی یابی نسل بعدی برای بررسی ژنهایی که ممکن است دارای گونههایی تکنوکلئوتیدی یا گونههایی با تعداد کپی بیشتر استفاده کرد. سنجش MLPA همچنین میتواند در تشخیص مولکولی بیماریهای ژنتیکی که با حضور متیلاسیون غیرطبیعی DNA مشخص میشوند، استفاده شود.
تکنیک MLPA چیست؟
تقویت پروب وابسته به بستن چندگانه (MLPA) روشی است که با انجام یک واکنش ساده PCR با استفاده از یک جفت پرایمر PCR اعداد کپی نابجا را در حداکثر 60 توالی اسیدنوکلئوتیدی خاص شناسایی میکند. واکنشهای MLPA تنها به 50نانوگرم DNA کروموزومی انسان نیاز دارد.
اگرچه اکثر بیماریهای ارثی انسان به دلیل ناهنجاری در توالی DNA ژنهای خاص است. توصیف صحیح حذفها و تکرارهای ژنی یک نکته بسیار مهم به منظور شناسایی همبستگی فنوتیپ، ژنوتیپ است. در واقع حذف یا تکرار ژن کامل و جزئی میتواند یک اثر فنوتیپی کاملا متفاوت ایجاد کند. یک تکثیر کامل ژن میتواند به دلیل وجود یک نسخه اضافی از ژن منجربه بیماری شود، درحالی که یک تکرار جزئی میتواند منجربه ازدست دادن عملکرد آن نسخه ژن شود.
برای مثال میتوان “DMD” را نام برد که در آن تکرارها بر برخی اگزونهای داخل تاثیر میگذارند. علاوه بر این نشان داده شدهاست که اساس ژنتیکی چندین بیماری انسانی مربوط به تنوع شماره کپی (CNV) است، که عموما بهعنوان یک قطعه DNA طولانیتر از 1کیلوبایت تعریف میشود. درحال حاضر، نسبت واقعی بیماریهای ژنتیکی ناشی از CNV”” ناشناخته است، اما ممکن است قابلتوجه باشد.
در میان رویکردهای مختلف مورد استفاده در سالهای اخیر برای تشخیص حذف، تکثیر ژن یا اعتبارسنجی نتایج آرایه “CGH” در تجزیهوتحلیل CNVs علاقه خاصی به سنجش تقویت پروب وابسته به بستن چندگانه (MLPA) اختصاص داده شدهاست. این تکنیک قادر است تا 50 توالی DNA را در یک واکنش تجزیهوتحلیل کند و تنوع تعداد کپی ژنهای خاص، از جمله بازآراییهای کوچک درون ژنی را تشخیص دهد.
کاربرد تکنیک MLPA
کاربردهای این تکنیک عبارتاند از:
- تشخیص حذف یا تکثیر اگزون مانند ژنهای “BRCA1″، “MSH2″، “MLH1” انسانی؛
- تشخیص تریزومیها مانند سندروم داون؛
- شناسایی ناهنجاریهای کروزومی در ردههای سلولی و نمونههای تومور؛
- تشخیص”SNP” و جهش؛
- تجزیهوتحلیل متیلاسیون DNA؛
- برای پالایش نقاط شکست انواع کپی درون ژنی شناسایی شده توسط ریزآرایهها؛
- گاهی اوقات برای آزمایش انواع تکنوکلئوتیدی خاص (که پروبها در کیت موجود است)؛
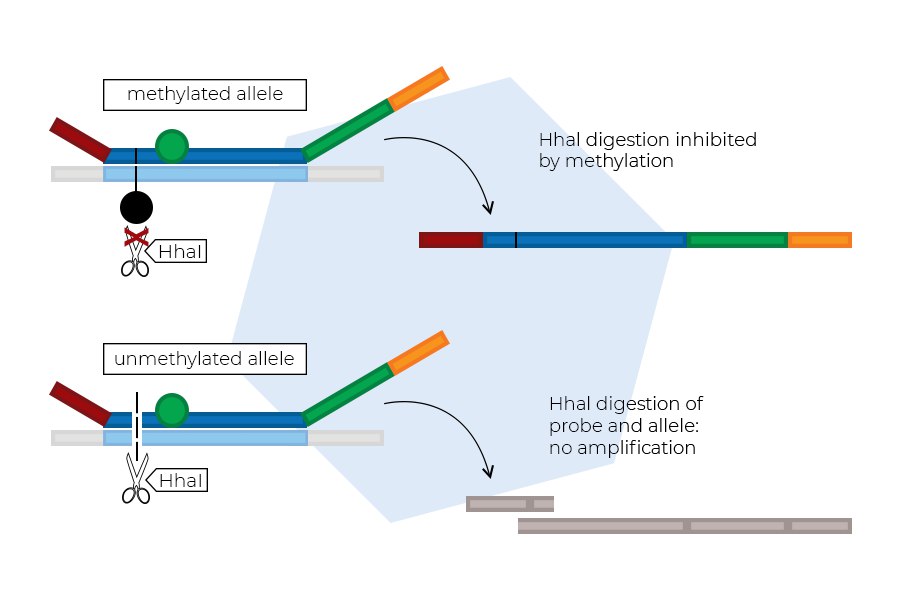
- در “MS-MLPA” (در MLPA خاص متیلاسیون) برای تعیین وضعیت متیلاسیون نواحی چاپ شده یا پروموتور که در آن متیلاسیون نابجا با بیماری مرتبط است.
تاریخچه MLPA
MLPA توسط یان شوتن، دانشمند هلندی اختراع شد. این روش برای اولینبار در سال 2002 در مجله علمی تحقیقات اسیدنوکلئیک منتشر شد. اولین کاربردهای آن شامل تشخیص حذف اگزون در ژنهای انسانی BRCA1″”، “MSH2” و “MLH1” بود که با سرطان سینه و روده بزرگ ارثی مرتبط هستند. اکنون MLPA برای تشخیص صدها اختلال ارثی و همچنین برای تعیین پروفایل تومور استفاده میشود.
روش MLPA
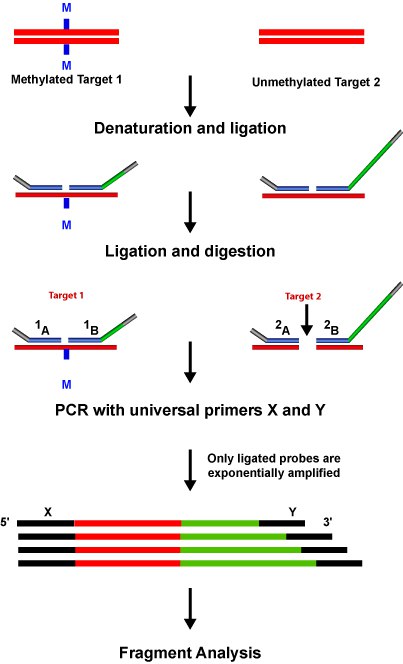
روش MLPA ، یک روش PCR مالتی است که حداکثر از 40پروب استفاده میکند که هر کدام برای یک توالی DNA متفاوت (عمدتا اگزونهای یک ژن خاص)، برای ارزیابی تعداد کپی DNA نسبی هر توالی اختصاص دارد. هر پروب از دو نیمه و همچنین از یک توالی هدف خاص و یک توالی پرایمر جهانی تشکیل شدهاست که امکان تقویت مالتی پلکس PCR همزمان را برای همه پروبها فراهم میکند علاوه بر این یک یا هر دو نیمه پروب حاوی یک توالی پرکننده است که امکان تمایز دز طول الکتروفورز از طول خود پروب و درنتیجه اندازه محصول تقویتی را فراهم میکند.
واکنش MLPA را میتوان به پنجمرحله تقسیمبندی کرد:
- دناتورهکردن DNA و هیبریداسیون پروب؛
- واکنش بستن پروب: کاوشگرها در مکانهایی که توالی دقیق هدف وجود داشته باشد، متصل میشوند؛ اگر کاوشگرهای جفتی بلافاصله به یکدیگر متصل شوند، انتهای آنها به هم دیگر میپیوندند؛
- تقویت PCR: در انتهای هریک از جفت پروبها، یک محل اتصال پرایمر وجود دارد. هنگامیکه پروبها در یک جفت بسته باشند، تقویت PCR میتواند اتفاق بیافتد.
- جداسازی محصولات تقویت با الکتروفورز: از آنجایی که فقط پروبهای بستهشده در طی واکنش PCR بعدی تقویت میشوند، تعداد محصولات بستن پروب معیاری برای تعداد توالیهای هدف در نمونه است. سپس محصولات PCR براساس اندازه با استفاده از الکتروفورز مویرگی در شرایط دناتورهکردن جدا میشوند.
ارتفاع یا مساحت پیکهای فلورسانس مشتق شده از PCR اندازهگیری میشود، مقدار محصول PCR پس از نرمالسازی و مقایسه آن با نمونههای DNA کنترل و اندازهگیری میشود. بنابراین مقدار نسبی توالی هدف در نمونه DNA ورودی را نشان میدهد؛
- تجزیهوتحلیل دادهها: یک نکته مهم در استفاده از روش MLPA بهعنوان یک آزمایش ژنتیکی برای تشخیص مولکولی برای حذف، تکثیر ژن و تفسیر نتایج MLPA است.
همچنین بخوانید: دستگاه Gradient Thermocycler PCR
مالتی پلکس PCR معمولی از یک جفت پرایمر برای هر قطعه استفاده میکند که در نتیجه واکنشی بهوجود میآید که حاوی تعداد زیادی مجموعه پرایمرهای مختلف است. راندمان پرایمر جفتهای مختلف پرایمر میتواند متفاوت باشد، بنابراین استفاده از مالتی پلکس PCR معمولی برای کمیسازی نسبی توالیهای هدف را دشوار میکند. علاوه بر این، تفاوتهای کوچک در شرایط واکنش میتواند منجربه تفاوتهای بزرگ در نتایج به دست آمده شود زیرا هر جفت آغازگر ممکن است به تغییر واکنش نشان دهند.
در مقابل تمام قطعات در یک واکنش MLPA با استفاده از همان جفت پرایمر PCR تقویت میشوند و واکنش را بسیار قوی میکنند. ترفند MLPA این است که در آن DNA تکثیر نمیشود بلکه پروبهای MLPA به نمونه اضافه میشوند. هر پروب MLPA از دو الیگونوکلئوتید جفتی تشکیل شدهاست که هر کدام حاوی یکی از توالیهای آغازگر PCR به اضافه یک توالی مکمل توالی هدف DNA است.
این دو نوکلئوتید کاوشگر به مکانهای هدف مجاور هیبرید میشوند. تنها زمانی که دو الیگونوکلئوتید پروب به هدف خود هیبرید میشوند، میتوان آنها را به یک پروب منفرد متصل کرد که شامل توالی پرایمر رو به جلو و معکوس باشد. این پروبهای متصل شده به صورت تصاعدی در طی واکنش تقویت PCR تقویت میشوند، در حالیکه الیگونوکلئوتیدهای پروب غیرمرتبط منفرد اینگونه نیستند.
بنابراین تعداد محصولات بستن پروب یک پروب به تعداد توالیهای هدف در نمونه بستگی دارد. پس از PCR محصولات تقویتشده توسط الکتروفورز مویرگی جدا میشوند. مجموعه پروب MLPA طوری طراحی شدهاست که طول هر یک از محصولات تقویتکننده آن منحصربهفرد باشد. طول در محدودهای با اندازه کلی بین 500-120 نوکلئوتید گامبهگام افزایش مییابد. این محدوده اندازه جداسازی قطعه بهینه و پس زمینه کم را در ژلها فراهم میکند.
تنها تجهیزات مورد نیاز برای انواع مختلفی از تجزیهوتحلیل وجود دارد که میتوان با استفاده از MLPA انجام داد، از جمله:
- “Copy number analysis”: این نوع آنالیز برای تعیین تعداد کپی یک توالی DNA خاص در یک نمونه استفاده میشود. کاوشگرهای MLPA برای هدف قرار دادن مناطق خاصی از ژنوم طراحی شده اند و از تقویت آن پروبها برای تعیین تعداد کپی توالی هدف استفاده میشود.
- “Gene dosage analysis”: این تجزیهوتحلیل برای تعیین تعداد کپی ژنهای خاص در یک نمونه استفاده میشود و میتواند برای تشخیص حذف و تکرار در ژنهای مرتبط با اختلالات ژنتیکی مختلف استفاده شود.
- “Methylation analysis”:همچنین میتواند برای تجزیهوتحلیل الگوهای متیلاسیون DNA استفاده شود. متیلاسیون فرایندی است که DNA را تغییر میدهد و میتواند بر بیان ژن تأثیر بگذارد .کاوشگرهای MLPA را میتوان برای هدف قرار دادن مناطقی از ژنوم که به عنوان متیله شناخته شدهاند طراحی کرد و از تقویت آن پروبها میتوان برای تعیین وضعیت متیلاسیون مناطق هدف استفاده کرد.
- “Tumor analysis”: از MLPA میتوان برای تجزیهوتحلیل نمون های DNA از تومورها برای شناسایی تکثیر یا حذف ژنی که ممکن است با پپیشرفت سرطان مرتبط باشد، استفاده کرد.
برای اطمینان از صحت و قابلیت اطمینان نتایج MLPA، چندین استاندارد و دستورالعمل برای عملکرد و تفسیر سنجشهای MLPA ایجاد شدهاست.
همچنین بخوانید: واکنش زنجیرهای پلیمراز PCR، از نون شب واجبتر در ژنتیک
در اینجا برخی از استانداردهای کلیدی تکنیک MLPA آورده شدهاست:
- “Probe design”: کاوشگرهای MLPA باید با دقت طراحی شوند تا مناطق خاصی از ژنوم را هدف قرار دهند و از واکنش متقابل با مناطق دیگر جلوگیری کنند. پروبها نیز باید براساس ویژگیهای عملکردی آنها مانند حساسیت و ویژگی انتخاب شوند.
- “Quality control”: اقدامات کنترل کیفیت باید در هر مرحله از سنجش MLPA اجرا شود، از جمله جداسازی DNA، هیبریداسیون پروب، بستن و تقویت .اقدامات کنترل کیفیت میتواند شامل استفاده از کنترلهای مثبت و منفی، تکرار آزمایش نمونهها و نظارت بر عملکرد سنجش در طول زمان باشد.
- “Data analysis”: دادههای MLPA باید با استفاده از روشهای آماری مناسب برای تعیین تغییرات تعداد نسخهها و شناسایی مصنوعات یا خطاهای احتمالی تجزیهوتحلیل شوند .ابزارهای نرمافزاری مختلفی برای تجزیهوتحلیل دادههای MLPA موجود است و انتخاب ابزار باید براساس دقت، سرعت و سهولت استفاده باشد.
- “Interpretation”:نتایج MLPA باید در چارچوب سوال بالینی یا تحقیقاتی مورد بررسی تفسیر شود .تفسیر باید عواملی مانند اندازه و محل”CNV”، الگوی وراثت و اهمیت بالقوه بالینی CNV را در نظر بگیرد
- “Reporting”: نتایج MLPA باید به شیوهای واضح و مختصر گزارش شود، از جمله اطلاعات مربوط به نمونههای آزمایش شده، سنجش خاص MLPA مورد استفاده، نتایج به دست آمده و تفسیر آن نتایج .این گزارش همچنین باید شامل هرگونه محدودیت یا اخطار مرتبط با سنجش یا نتایج بهدستآمده باشد.
- Validation: سنجشهای MLPA باید قبل از استفاده در محیطهای بالینی یا تحقیقاتی اعتبارسنجی شوند تا اطمینان حاصل شود که قابل اعتماد و دقیق هستند .اعتبارسنجی باید شامل آزمایش طیف وسیعی از نمونهها باCNV های شناخته شده و همچنین ارزیابی عملکرد سنجش در طول زمان باشد .
مزایا و محدودیتهای تکنیک MLPA
مزایای این تکنیک شامل موارد زیر میشود:
- استاندارد طلایی برای تشخیص CNV در سطح اگزون (در کنار برخی ریزآرایهها)؛
- قدرتمند؛
- سریع؛
- مقرون به صرفه؛
- وضوح بالا؛
- تشخیص دقیق حذف یا تکثیر اگزون؛
- برای تشخیص متیلاسیون (MS-MLPA) قابل تغییر است؛
- توان عملیاتی بالاتر و کار کمتری نسبت به FISH.
محدودیتهای این تکنیک شامل موارد زیر میشود:
- کیتهای تجاری MLPA برای همه ژنها در دسترس نیستند؛
- در جایی که یک تکرار تشخیص داده میشود، مکان یا جهت مواد تکراری مشخص نیست؛
- بازآرایی متعادل را تشخیص نخواهد داد؛
- ممکن است موزاییکیسم را تشخیص ندهد؛
- ممکن است حذفهای کوچک اینترونیک را که خارج از نواحی مورد هدف کاوشگرهای کیت قرار دارند، از دست بدهد؛
- اگر حذف یا تکثیر فراتر از ناحیه مورد هدف کاوشگرها در کیت باشد، ممکن است یک روش ثانویه برای بررسی این مورد نیاز باشد؛
- SNAها را شناسایی نمیکنند، مگر اینکه بهطور خاص توسط MLPA پروبهای مورد هدف قرار گرفته باشد.
جمعبندی
سنجش MLPA در چندسال اخیر به یک تکنیک پرکاربرد در آزمایشگاههایی تبدیل شدهاست که آزمایشهای ژنتیکی را برای تشخیص مولکولی چندین بیماری انجام میدهند. MLPAاز جفت پروبهای الیگونوکلئوتیدی استفاده میکنند (مولکولهای کوچکی که برای هیبریدشدن DNA با یک توالی ژنومی خاص طراحی شدهاند).
برای تشخیص ناهنجاریهای دوز در نمونه (مانند حذف یا تکثیر اگزون) میتوان تفاوتها در ارتفاع پیک محصولات تقویت پروبهای هدف نمونه را با نمونههای مرجع با شماره کپی مشخص مقایسه کرد.کیفیت واکنش با وجود پیکهای کنترلی که اطلاعاتی درمورد کارایی تقویت و مقدار صحیح DNA مورد استفاده برای واکنش ارائه میدهد، ارزیابی میشود. نکته کلیدی در واکنش MLPA این است که PCR توالیهای هدف را تقویت نمیکند، بلکه پروبهای بسته شده را تقویت میکند.
نویسنده: کوثر حاجیپور
ویراستار: مهرشید موسویون
منابع:
- https://www.genomicseducation.hee.nhs.uk/genotes/knowledge-hub/multiplex-ligation-dependent-probe-amplification-malpa/
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3317712
- https://support.mrcholland.com/kb/articles/what-is-mpla-and-how-dies-it-work