فهرست مطالب
توالی DNA به روشهای MLPA & CGH
سیتوژنتیک علمی است که به مطالعه ی ساختارهای سلولی به ویژه تغییرات عددی و ساختاری کروموزوم ها می پردازد. بسیاری از اختلالات ژنتیکی انسان ناشی از ناهنجاری های نامتعادل کروموزومی است که در آنها دو برابر شدگی یا از بین رفتن خالص محتوای ژنتیکی وجود دارد.
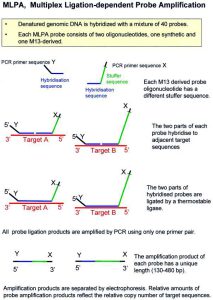
Multiplex ligation-dependent probe amplification یکی از جدیدترین روشهای مولکولی، برای تشخیص سریع و دقیق تعداد نسخه های ژنی و جهش های نقطه ای، در طیف وسیعی از بیماریهای ژنتیکی انسانی است. این روش قادر به سنجش تعداد DNA و بررسی تعداد نسخه های ژنی در 50 تا 60 محل مختلف، در یک واکنش سادهی PCR میباشد. در این روش با طراحی مجموعهای از پروب ها که هر کدام مکمل ناحیه ای مشخصی از ژنوم هستند، تعداد نسخه ژنی در یک منطقه را میتوان مشخص کرد. اساس این روش بر پایه هیبرید شدن هر جفت پروب با توالی مشخصی در ژنوم، به صورت اختصاصی است. به طوری که حتی تغییر یک نوکلئوتید در محل اتصال 2 پروب، قابل شناسایی است و از این خصوصیت میتوان برای طراحی پروب های اختصاصی جهت بررسی جهش های نقطه ای شناخته شده نیز استفاده کرد.
کاربردهای روش MLPA
-
بررسیdel/dup در ژنوم به ویژه:
del/dup بزرگ با محدودهی نامشخص
del/dup در برگیرندهی اگزون های متعدد مانند بررسی ژن دیستروفین در افراد مشکوک به دیستروفی عضلانی دوشن (با این روش علاوه بر تشخیص بیماران، به سادگی میتوان ناقلین را شناسایی کرد.)
- بررسی تعداد نسخه ای ژنی در محل های خاصی در کروموزومهای مختلف جهتscreening ژنهای مختلف.
- بررسی جهش های نقطه ای و پلی مورفیسم های شناخت هه شده.
- بررسی کمی mRNA
- بررسی وضعیت متیلاسیون مناطق پروموتری و یا imprinted
- بررسی DNA استخراج شده از بافت (paraffin imbedded یا formalin treated)
مراحل واکنش MLPA
واکنش MLPAرا میتوان به پنج مرحله تقسیم کرد:
- دناتوراسیون DNA و هیبریداسیون پروب
- لایگیشن (اتصال) DNA
- تکثیر بهوسیله PCR
- جداسازی محصولات PCR توسط الکتروفورز
- تجزیه و تحلیل داده ها
ابتدا، DNA واسرشتشده و پروب های MLPA به DNA متصل میشوند.
دو نیم پروب، قادر به تشخیص توالی های هدف خاصی هستند. این توالی باید بسیار اختصاصی بوده و دارای تطابق کامل با پروب ها و بدون یک گپ باشد.
پس از هیبریداسیون، PCR انجام میشود. چون فقط پروب های متصلشده در طول واکنش PCR بعدی تکثیر میشوند، اندازه گیری تعداد محصولات اتصال پروب، برابر تعداد توالی هدف در نمونه است.
در انتها محصولات PCR با استفاده از تکنیک الکتروفورز، از نظر اندازه جدا میشوند.
comparative genomic hybridization(CGH)
CGH روشی با قدرت تفکیک بالا برای بررسی حذفها و یا اضافه شدگی ها در کل ژنوم و شناسایی عدم تعادل کروموزومی است. این آزمایش را کاریوتیپ مولکولی هم می نامند. همچنین به طور ویژه برای شناسایی علل عقب ماندگی های ذهنی یا ناهنجاری های مادرزادی کاربرد دارد. این آزمایش را میتوان جایگزین روش های قدیمی مطالعهی کروموزمی و تعیین کاریوتیپ در بعضی موارد کرد. اساس این آزمایش مقایسه هیبرید شدگی ژنوم در توالی ژن است.
مراحل واکنش CGH
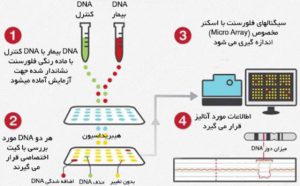
ابتدا DNA از یک نمونه (به عنوان مثال خون یا پوست) استخراج میشود.
DNAمورد آزمایش با یک رنگ فلورسنت برچسب گذاری شده، در حالی که DNA مرجع با یک رنگ دیگر برچسب گذاری میشود.
دو DNA ژنومی (تست و مرجع) با هم مخلوط و روی اسلاید شیشهای توالی ژن هیبرید میشوند. از آنجا که DNA واسرشت شده است، تک رشته ای هستند. بنابراین، هنگامی که به اسلاید منتقل میشوند، با پروب های تک رشته ای هیبرید میشوند.
در انتها از سیستم های تصویربرداری دیجیتال برای ضبط و اندازهگیری شدت نسبی فلورسانس پروبهای DNA برچسب خورده استفاده میشود. نسبت فلورسانس سیگنال های هیبریداسیون مرجع آزمایش در موقعیت های مختلف، در امتداد ژنوم تعیین میشود و اطلاعات مربوط به تعداد کپی نسبی توالی های موجود در ژنوم آزمون را در مقایسه با ژنوم معمولی ارائه میدهد.
مقایسه ی دو روش MLPA & CGH
مزایای :MLPA
تشخیص بازسازیهای کوچک، تشخیص همزمان حداکثر 40 هدف، توان بالا در بررسی جهش های نقطه ای در متیله شدن و تعداد نسخه در یک آنالیز، هزینه کم، نیاز به نمونه اندک بهعنوان الگو 20 تا 100 نانوگرم، عدم نیاز به کشت سلول.
معایب :MLPA
عدم تشخیص کپی های خنثی در هتروزیگوسیتی، عدم توانایی در تشخیص موزاییسم (هتروژنی تومور)، آلودگی با سلولهای سالم و عدم تشخیص درست، وقت گیر، پیچیده بودن و هزینه های بالای تهیه پروب.
مزایای :CGH
میتواند بازسازی های بسیار کوچک را تشخیص دهد، امکان بررسی کل ژنوم با پروب وجود دارد، هزینه کم به ازای داده های خروجی.
معایب CGH:
تجهیزات گران قیمت، عدم تشخیص کپی های خنثی در هتروزیگوسیتی، بازده پایین در تشخیص های پیشاز تولد، مشخص نبودن تفسیر نتایج تغییرات کروموزومی به طور دقیق.
نتیجه گیری:
با توجه به مزایای روش MLPA، کاربرد آن در زمینه بررسی مولکولی بیماری های مختلف در حال گسترش است. اکنون MLPA در زمینه شناسایی ناقلین و تشخیص افراد مبتلا به بیماری های ژنتیک مختلف، بهخصوص بیماریهای ناشی از جهش های حذفی بزرگ و با محدوده ژنی متنوع مثل آلفا تالاسمی، بتا تالاسمی و دیستروفی عضلانی دوشن و… بهکار میرود.
همچنین برخلاف تکنیک های سنتی استفاده شده برای تشخیص تعداد کپی ها، که به بررسی و دانش قبلی ناحیه مورد بررسی متکی بود، CGH میتواند برای اسکن سریع کل ژنوم برای بررسی عدم تعادل تعداد ژنی استفاده شود. علاوه بر این، CGH بهگسترهی سلولهای متافازی (در حال تقسیم) نیاز ندارد. با این حال، مانند روش های قبلی سیتوژنتیک، وضوح CGH برای بیشتر کاربردهای بالینی محدود به تغییرات 5-10 مگابایت است.
منابع: